网址:http://m.1010jiajiao.com/timu_id_428164[举报]
请你根据所学知识及有关信息完成下列各题:
(1)H3AsO3中As元素的化合价为_________。
(2)从经济、易得、实用的角度考虑,你认为投入的5.0×104 kg白色固体是_________。
查看习题详情和答案>>硫酸亚锡(SnSO4)是一种重要的硫酸盐,主要用于电镀工业的镀锡、铝合金表面的氧化着色、印染工业的媒染剂、双氧水去除剂等。某研究小组设计SnSO4制备路线如下:

查阅资料:
Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnCl2易水解生成难溶物Sn(OH)Cl(碱式氯化亚锡)。
请回答下列问题:
(1)SnCl2粉末需加浓盐酸进行溶解,请用平衡移动原理解释原因 。
(2)加入Sn粉的作用有两个:①调节溶液pH ② 。
(3)反应Ⅰ生成的气体为CO2,得到的沉淀是SnO。该沉淀经过滤后需漂洗,如何证明沉淀已经洗涤完全? 。
(4)多步操作包含的具体实验步骤的名称可以是: 。
(5)酸性条件下,SnSO4还可以用作双氧水去除剂,发生反应的离子方程式是 。
(6)该小组通过下列方法测所用锡粉样品的纯度(杂质不参与反应):
①将试样溶于盐酸中,发生的反应为:Sn + 2HCl→SnCl2 + H2↑;
②加入过量的FeCl3 ;
③用已知浓度的K2Cr2O7滴定生成的Fe2+,发生的反应为:6FeCl2 + K2Cr2O7 + 14HCl →6FeCl3 + 2KCl + 2CrCl3 +7H2O
取1. 226 g 锡粉样品,经上述各步反应后,共用去0.1000 mol/L K2Cr2O7溶液32.00 mL。则该锡粉样品中锡的质量分数是
查看习题详情和答案>>
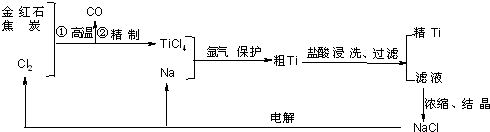
(1)粗TiCl4中含有少量FeCl3、SiCl4等,它们的部分性质如下:
| 物质 | 沸点/℃ | 在水中 | 在乙醚中 |
| TiCl4 | 136 | 强烈水解 | 易溶 |
| SiCl4 | 58 | 强烈水解 | 易溶 |
| FeCl3 | 303(升华) | 水解 | 易溶 |
A.用水溶解后,重结晶 B.蒸馏 C.用乙醚萃取后,分液
(2)写出金红石高温反应制取TiCl4 的化学方程式
(3)写出电解熔融NaCl的化学方程式
(4)粗钛产品粉碎后用盐酸浸洗.其主要目的是
(5)Ti可以溶解在浓HF溶液中,请完成下列离子方程式.

(1)粗TiC14中含有少量FeCl3、SiCl4等,它们的部分性质如下:
| 物质 | 沸点/℃ | 在水中 | 在乙醚中 |
| TiC14 | 136 | 强烈水解 | 易溶 |
| SiCl4 | 58 | 强烈水解 | 易溶 |
| FeCl3 | 303(升华) | 水解 | 易溶 |
(2)写出用惰性电极电解熔融NaCl时阳极的电极反应式:
(3)Ti可溶解在浓HF溶液中,请完成下列离子方程式:
| F | 2- 6 |
(4)如图2所示是一个制取氯气并以氯气为原料进行反应的装置.
①装置A中发生反应的化学方程式为
| ||
| ||
②在实验室中,某同学欲用如图3所示装置净化氯气,则M、N中应盛放的试剂分别是
③实验开始时,先点燃A处的酒精灯,打开旋塞K,让C12充满整个装置,再点燃C处酒精灯.Cl2通过装置M、N再进入装置C,与装置C中的固体粉末发生氧化还原反应生成CO气体.试写出装置C中发生反应的化学方程式:
| ||
| ||