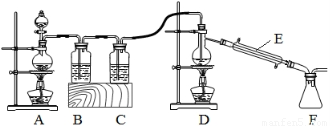
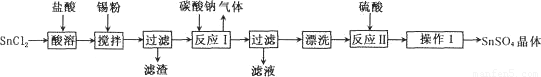
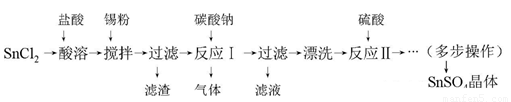
题目内容
硫酸亚锡(SnSO4)是一种重要的硫酸盐,主要用于电镀工业的镀锡、铝合金表面的氧化着色、印染工业的媒染剂、双氧水去除剂等。某研究小组设计SnSO4制备路线如下:
查阅资料:
Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnCl2易水解生成难溶物Sn(OH)Cl(碱式氯化亚锡)。
请回答下列问题:
(1)SnCl2粉末需加浓盐酸进行溶解,请用平衡移动原理解释原因 。
(2)加入Sn粉的作用有两个:①调节溶液pH ② 。
(3)反应Ⅰ生成的气体为CO2,得到的沉淀是SnO。该沉淀经过滤后需漂洗,如何证明沉淀已经洗涤完全? 。
(4)多步操作包含的具体实验步骤的名称可以是: 。
(5)酸性条件下,SnSO4还可以用作双氧水去除剂,发生反应的离子方程式是 。
(6)该小组通过下列方法测所用锡粉样品的纯度(杂质不参与反应):
①将试样溶于盐酸中,发生的反应为:Sn + 2HCl→SnCl2 + H2↑;
②加入过量的FeCl3 ;
③用已知浓度的K2Cr2O7滴定生成的Fe2+,发生的反应为:6FeCl2 + K2Cr2O7 + 14HCl →6FeCl3 + 2KCl + 2CrCl3 +7H2O
取1. 226 g 锡粉样品,经上述各步反应后,共用去0.1000 mol/L K2Cr2O7溶液32.00 mL。则该锡粉样品中锡的质量分数是
(1)加入盐酸,使水解平衡向左移动,抑制Sn2+水解
(2)防止Sn2+被氧化
(3)取最后一次洗涤液,向其中加入AgNO3溶液,若无沉淀,则说明已洗涤干净
(4)加热浓缩、冷却结晶、过滤、洗涤
(5)Sn2+ + H2O2 +2H+=Sn4+ +2H2O
(6)93.18%
【解析】
试题分析:(1)SnCl2在水中发生水解反应:SnCl2+H2O Sn(OH)Cl+HCl. 生成难溶物Sn(OH)Cl,使溶液变浑浊。若加入HCl,可使平衡向逆反应方向移动,抑制Sn2+水解。
Sn(OH)Cl+HCl. 生成难溶物Sn(OH)Cl,使溶液变浑浊。若加入HCl,可使平衡向逆反应方向移动,抑制Sn2+水解。
(2)由于在酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。为了调节调节溶液pH并防止Sn2+被氧化为Sn4+要加入Sn粉。
(3)在反应过程中加入了HCl,沉淀的表面会有Cl-存在,只要能证明在洗涤液中无Cl-存在就可以证明沉淀已经洗涤完全。具体的检验方法是取最后一次洗涤液,向其中加入AgNO3溶液,若无沉淀,则说明已洗涤干净。
(4)在多步操作中所包含的具体实验步骤的名称是加热浓缩、冷却结晶、过滤、洗涤。
(5)酸性条件下,SnSO4与双氧水发生反应的离子方程式是Sn2+ + H2O2 +2H+=Sn4+ +2H2O。
(6)在处理过程中发生的反应为:Sn + 2HCl=SnCl2 + H2↑;2FeCl3+SnCl2=2FeCl2+ SnCl4
6FeCl2 + K2Cr2O7 + 14HCl =6FeCl3 + 2KCl + 2CrCl3 +7H2O。由方程式得关系式3Sn—3SnCl2 —6FeCl3 — K2Cr2O7.因为n(K2Cr2O7)=C·V=0.1000 mol/L×0.032L=3.2×10-3mol.所以n(Sn)= 3×3.2×10-3mol =9.6 × 10-3mol.m(Sn)=n·M=9。6×10-3mol×119g/mol=1.14g. 该锡粉样品中锡的质量分数是(1.14g÷1. 226 g) ×100%=93.18%.
考点:考查在电镀工业的镀锡、铝合金表面的氧化着色、印染工业的媒染剂、双氧水去除剂等有重要作用的SnSO4制备、性质反应原理等的知识。

 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案