摘要:(1)布置作业:现有一个0.53g的工业纯碱样品(含少量NaCl等不与酸反应.不与CaCl2生成沉淀的杂质).需测定样品中Na2CO3的质量分数.设计初步方案.(2)课堂分小组讨论.小组代表发言.评价补充.完善确定以下几种实验方案: 方案一:反应原理 2H++CO32?=H2O+CO2↑基本方法:①配制标准浓度的酸溶液,②将样品溶于水中.用标准酸溶液进行滴定,③测量消耗酸溶液的体积.计算Na2CO3的质量分数. 方案二:反应原理2H++CO32?=CaCO3↓基本方法:①在样品中加入足量的强酸溶液.使CO2气体全部逸出,②用吸收剂吸收逸 出的CO2气体,③根据吸收剂质量的增加.计算Na2CO3的质量分数. 方案三:反应原理 Ca2++CO32?=H2CO3基本方法:①在样品溶液中加足量的氯化钙溶液.使其沉淀完全,②过滤后.将沉淀进行洗涤.烘干,③称量纯净.干燥的沉淀质量.计算Na2CO3的质量分数.(3)对每一方案引导质疑.形成详案.如方案二.该方案的核心是测量反应中逸出的二氧化碳的质量.请选择主要仪器.设计实验装置.讨论后得出.A―主要反应发生装置:烧瓶和分液漏斗,试剂:样品和硫酸.B―干燥装置:大试管,试剂:浓H2SO4.C―吸收装置:干燥管.U形管,试剂:碱石灰.质疑:①为什么选用硫酸与样品反应逸出二氧化碳?能否改用盐酸?②二氧化碳气体密度较大.怎样保证硫酸与碳酸钠应完全反应后.二氧化碳气体能够从发生装置中全部逸出.
网址:http://m.1010jiajiao.com/timu_id_428104[举报]
当今水体的污染成为人们关注的焦点.利用化学原理可以对工厂排放的废水进行有效检测与合理处理.
(1)废水中的N、P元素是造成水体富营养化的关键因素,农药厂排放的废水中常含有较多的NH4+和PO43-,一般可以通过以下两种方法将其除去.
①方法一:将Ca(OH)2或CaO 投加到待处理的废水中,生成磷酸钙,从而进行回收.已知常温下Ksp[Ca3(PO4)2]=2.0×10-33,当处理后的废水中c(Ca2+)=2.0×10-7 mol?L-1时,溶液中c(PO43-)=
②方法二:在废水中加入镁矿工业废水,就可以生成高品位的磷矿石--鸟粪石,反应的方程式为Mg2++NH4++PO43-=MgNH4PO4↓.该方法中需要控制污水的pH为7.5~10.0,若pH高于10.7,鸟粪石的产量会大大降低.其原因可能为
(2)染料工业排放的废水中含有大量有毒的NO2-,可在碱性条件下加入铝粉除去,加热处理后的废水会产生能使湿润的红色石蕊试纸变蓝的气体.现有1.0t含氮质量分数为0.035%的NO2-废水,用此法完全处理后生成的AlO2-的物质的量为
(3)工业上也会利用铝粉除去含氮废水中的NO3-.现在处理100m3浓度为2.0×10-4mol?L-1的NaNO3溶液,加入一定量的2mol?L-1的NaOH溶液和铝粉,控制溶液pH在10.7左右,加热,使产生的气体全部逸出,当NaNO3反应掉一半时,测得氮气和氨气的体积比为4:1,求此过程中消耗铝的质量.(写出计算过程,无过程以0分计算)
查看习题详情和答案>>
(1)废水中的N、P元素是造成水体富营养化的关键因素,农药厂排放的废水中常含有较多的NH4+和PO43-,一般可以通过以下两种方法将其除去.
①方法一:将Ca(OH)2或CaO 投加到待处理的废水中,生成磷酸钙,从而进行回收.已知常温下Ksp[Ca3(PO4)2]=2.0×10-33,当处理后的废水中c(Ca2+)=2.0×10-7 mol?L-1时,溶液中c(PO43-)=
5.0×10-7
5.0×10-7
mol?L-1.②方法二:在废水中加入镁矿工业废水,就可以生成高品位的磷矿石--鸟粪石,反应的方程式为Mg2++NH4++PO43-=MgNH4PO4↓.该方法中需要控制污水的pH为7.5~10.0,若pH高于10.7,鸟粪石的产量会大大降低.其原因可能为
当pH高于10.7时,溶液中的Mg2+、NH4+会与OH-反应,平衡向逆反应方向移动
当pH高于10.7时,溶液中的Mg2+、NH4+会与OH-反应,平衡向逆反应方向移动
;与方法一相比,方法二的优点为能同时除去废水中的氮,充分利用了镁矿工业废水
能同时除去废水中的氮,充分利用了镁矿工业废水
.(2)染料工业排放的废水中含有大量有毒的NO2-,可在碱性条件下加入铝粉除去,加热处理后的废水会产生能使湿润的红色石蕊试纸变蓝的气体.现有1.0t含氮质量分数为0.035%的NO2-废水,用此法完全处理后生成的AlO2-的物质的量为
50mol
50mol
.(3)工业上也会利用铝粉除去含氮废水中的NO3-.现在处理100m3浓度为2.0×10-4mol?L-1的NaNO3溶液,加入一定量的2mol?L-1的NaOH溶液和铝粉,控制溶液pH在10.7左右,加热,使产生的气体全部逸出,当NaNO3反应掉一半时,测得氮气和氨气的体积比为4:1,求此过程中消耗铝的质量.(写出计算过程,无过程以0分计算)
(1)一定条件下CH3COOH溶液中的电离平衡为:CH3COOH?CH3COO-+H+△H>0
下列方法中,可以使0.10mol?L-1CH3COOH溶液中CH3COOH电离程度增大的是
a.加入少量0.10mol?L-1的稀盐酸 b.加热CH3COOH溶液
c.加水稀释至0.010mol?L-1 d.加入少量冰醋酸
e.加入少量氯化钠固体 f.加入少量0.10mol?L-1的NaOH溶液
(2)25℃时,该电离平衡的平衡常数为1.75×10-5.现有:①0.10mol?L-1CH3COOH溶液 ②0.0010mol?L-1 CH3COOH溶液
其c(H+)之比为①:②=
(3)25℃时,向0.10mol?L-1CH3COOH溶液中加入一定量固体CH3COONa(假设溶液体积不变),若溶液中c(CH3COO-)为1.0mol?L-1,则溶液中c(H+)=
查看习题详情和答案>>
下列方法中,可以使0.10mol?L-1CH3COOH溶液中CH3COOH电离程度增大的是
bcf
bcf
.a.加入少量0.10mol?L-1的稀盐酸 b.加热CH3COOH溶液
c.加水稀释至0.010mol?L-1 d.加入少量冰醋酸
e.加入少量氯化钠固体 f.加入少量0.10mol?L-1的NaOH溶液
(2)25℃时,该电离平衡的平衡常数为1.75×10-5.现有:①0.10mol?L-1CH3COOH溶液 ②0.0010mol?L-1 CH3COOH溶液
其c(H+)之比为①:②=
10:1
10:1
.(提示:进行简化计算,平衡时的c(CH3COOH)可用起始浓度代替,水电离出的c(H+)、c(OH-)忽略不计,下同)(3)25℃时,向0.10mol?L-1CH3COOH溶液中加入一定量固体CH3COONa(假设溶液体积不变),若溶液中c(CH3COO-)为1.0mol?L-1,则溶液中c(H+)=
1.75×10-6
1.75×10-6
mol?L-1(计算结果保留小数点后两位有效数字).溶液中各种离子浓度关系是c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
.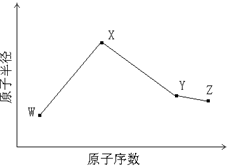 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为14,中子数为7;X的离子与NH4+具有相同的质子、电子数目; W与Y的氧化物均能导致酸雨的形成;Z的非金属性在同周期主族元素中最强.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为14,中子数为7;X的离子与NH4+具有相同的质子、电子数目; W与Y的氧化物均能导致酸雨的形成;Z的非金属性在同周期主族元素中最强.(1)Y在周期表中的位置是
(2)用电子式解释X与W能形成化合物X3W的原因
(3)X3W遇水可释放出使酚酞溶液变红的气体A,化学方程式是
(4)用惰性电极电解化合物XZ溶液从阴极释放出气体B,反应的离子方程式是
(5)已知W的单质与气体B在一定条件下可形成气体A,即:W2(g)+3B (g)?2A(g)△H=-92.4kJ?mol-1
在某温度时,一个容积固定的密闭容器中,发生上述反应.在不同时间测定的容器内各物质的浓度如下表:
| 时间 | 浓度(mol/L) | ||
| c(W2) | c(B) | c(A) | |
| 第0min | 4.0 | 9.0 | 0 |
| 第10min | 3.8 | 8.4 | 0.4 |
| 第20min | 3.4 | 7.2 | 1.2 |
| 第30min | 3.4 | 7.2 | 1.2 |
| 第40min | 3.6 | 7.8 | 0.8 |
②反应在第10min改变了反应条件,改变的条件可能是
a.更新了催化剂 b.升高温度 c.增大压强 d.增加B的浓度
③若反应从第30min末又发生了一次条件改变,改变的反应条件可能是
a.更新了催化剂 b.升高温度 c.增大压强 d.减小A的浓度.
手性分子是早就为化学工作者熟知的,但美国和日本的三位科学家却因为他们在手性分子可用来加速并控制化学反应方面的创造性工作,分享了2001年诺贝尔奖.在有机物分子中,若某碳原子连接着四个不同的原子或原子团,这种碳原子称为“手性碳原子”,凡只有一个手性碳原子的物质一定具有光化学活性.
(1)写出只含有一个碳原子的手性分子的结构式
(2)某有机物A(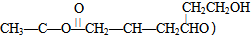 )是否具有光学活性
)是否具有光学活性
①酯化;②消去;③加成;④水解;⑤氧化;⑥还原
(3)某有机物B(C3H7O2N)具有如下性质:a.既能与强酸反应,又能跟强碱反应; b.具有光学活性.试回答:
①写出B中官能团的名称
②写出B的结构简式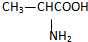
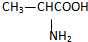 .
.
③若2分子B在一定条件下生成环状结构化合物C,则C的结构简式为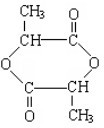
 .
.
④若B在一定条件下生成高分子化合物D,写出B→D的化学方程式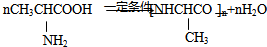
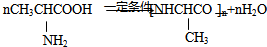 .
.
⑤写出B的一个不属于同类别的同分异构体结构简式
查看习题详情和答案>>
(1)写出只含有一个碳原子的手性分子的结构式
F-CHICl
F-CHICl
.(2)某有机物A(
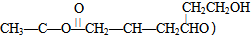 )是否具有光学活性
)是否具有光学活性是
是
(“是”或“否”),若要使其具有或失去光学活性,其发生的反应类型可以是①③⑤⑥
①③⑤⑥
.①酯化;②消去;③加成;④水解;⑤氧化;⑥还原
(3)某有机物B(C3H7O2N)具有如下性质:a.既能与强酸反应,又能跟强碱反应; b.具有光学活性.试回答:
①写出B中官能团的名称
氨基,羧基
氨基,羧基
.②写出B的结构简式
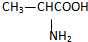
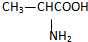
③若2分子B在一定条件下生成环状结构化合物C,则C的结构简式为


④若B在一定条件下生成高分子化合物D,写出B→D的化学方程式
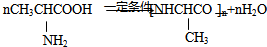
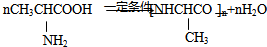
⑤写出B的一个不属于同类别的同分异构体结构简式
CH3CH2CH2NO2
CH3CH2CH2NO2
.
Ⅰ.某温度( t℃)时水的离子积为1×10-13,若将此温度下pH=11的氢氧化钠溶液aL与pH=1的稀硫酸bL混合(混合后溶液总体积的变化忽略不计),试通过计算填写以下不同情况时两种溶液的体积比:
(1)若所得混合液为中性,则a:b= ;
(2)若所得混合液的pH=2,则a:b= .
Ⅱ.在一条件下,CH3COOH溶液中存在电离平衡:CH3COOH
?CH3CH3COO-+H+△H>0,25℃时,该电离平衡的平衡常数为1.75×10-5.
(1)25℃时,现有:①0.100mol?L-1 CH3COOH溶液②0.00100mol?L-1 CH3COOH溶液
其c(H+)之比为①:②= .(提示:进行简化计算,平衡时的c(CH3COOH)可用起始浓度代替,水电离出的c(H+)、c(OH-)忽略不计,下同)
(2)25℃时,向0.10mol?L-1 CH3COOH溶液中加入一定量固体CH3COONa(假设溶液体积不变),若溶液中c(CH3COO-)为1.0mol?L-1,则溶液中c(H+)= mol?L-1(计算结果保留小数点后两位有效数字).
查看习题详情和答案>>
(1)若所得混合液为中性,则a:b=
(2)若所得混合液的pH=2,则a:b=
Ⅱ.在一条件下,CH3COOH溶液中存在电离平衡:CH3COOH
?CH3CH3COO-+H+△H>0,25℃时,该电离平衡的平衡常数为1.75×10-5.
(1)25℃时,现有:①0.100mol?L-1 CH3COOH溶液②0.00100mol?L-1 CH3COOH溶液
其c(H+)之比为①:②=
(2)25℃时,向0.10mol?L-1 CH3COOH溶液中加入一定量固体CH3COONa(假设溶液体积不变),若溶液中c(CH3COO-)为1.0mol?L-1,则溶液中c(H+)=