摘要:(2)磷的化合物的性质 ①P2O5磷酸(H3PO4)偏磷酸(HPO3)的酸酐P2O5+H2O(冷)=2HPO3 P2O5+3H2O(热)=2H3PO4P2O5吸浸性强可作干燥剂.②磷酸的性质纯净的磷酸是无色晶体.有吸湿性.藏躲畏水以任意比例混溶.浓H3PO4为无色黏稠液体.较稳定.不挥发.具有酸的通性.磷酸为三元酸.与碱反应时.当碱的用量不同时可生成不同的盐.磷酸和NaOH反应.1:1生成NaH2PO4,1:2生成Na2HPO4,l:3生成Na3PO4.介于l:1和1:2之间生成NaH2PO4和Na2HPO4的混合物.介于l:2和1:3之间生成Na2HPO4帮Na3PO4的混合物. 二.金属元素及其化合物 (一)金属元素概述
网址:http://m.1010jiajiao.com/timu_id_428020[举报]
在①CH2=CH2;②C6H6;③CH3CH2OH;④CH3COOH;⑤聚乙烯五种物质中:
(1)能使Br2的CCl4溶液褪色的是 ;
(2)属于高分子化合物的是 ;
(3)能与Na2CO3溶液反应的是 ;
(4)能发生酯化反应的是 ;
(5)既能发生取代反应又能发生加成反应的是 .
查看习题详情和答案>>
(1)能使Br2的CCl4溶液褪色的是
(2)属于高分子化合物的是
(3)能与Na2CO3溶液反应的是
(4)能发生酯化反应的是
(5)既能发生取代反应又能发生加成反应的是
(10分)A、B、C、D四种元素的原子序数均小于18,其最高正价数依次为1,4,5,7,已知B的原子核外次外层电子数为2。A、C原子的核外次外层电子数为8。D元素的最高价氧化物对应的水化物是已知含氧酸中最强酸,则:
(1)A的离子结构示意图是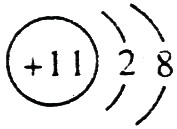 ,C的原子结构示意图是
,C的原子结构示意图是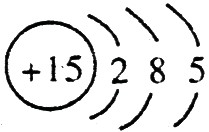 。
。
(2)C的最高价氧化物对应的水化物与A的氢氧化物生成三种盐,化学式分别为Na3PO4、Na2HPO4、NaH2PO4。
(3)C、D的气态氢化物稳定性由强到弱的顺序是 HCl>PH3。
【解析】 最高正价=原子最外层电子数,B元素的原子最外层电子数应为4,B元素原子的次外层电子数为2,为K层,B元素原子核外共有2+4=6个电子,B是6号元素碳;A、C原子次外层电子数为8,则A、C原子核外电子数分别是:2+8+1=11和2+8+5=15,所以A为11号元素钠,C为15号元素磷;在1~18号元素中,最高价为+7的只有氯元素(F无正价),而HClO4是已知含氧酸中最强的酸,故D为氯。
(1)钠总是+1价,其离子结构示意图为: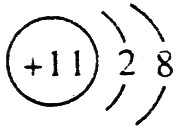 ;磷的原子序数是15,其原子结构示意图是:
;磷的原子序数是15,其原子结构示意图是: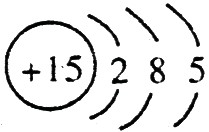 。
。
(2)磷的最高价(+5)氧化物对应的水化物是H3PO4,与NaOH反应生成:Na3PO4、NaH2PO4三种盐。
(3)P、Cl原子都具有3个电子层,核电荷数P(15)小于Cl(17),原子半径r(P)>r(Cl),所以非金属Cl>P,气态氢化物稳定性HCl>PH3。
查看习题详情和答案>>[化学--物质结构与性质]
(1)第ⅢA、ⅤA元素组成的化合物GaN、GaP、GaAs等是人工合成的新型半导体材料,其晶体结构与单晶硅相似.Ga原子的电子排布式为
(2)NH3分子的空间构型是:
(3)NH3与PH3相比,热稳定性更强的是:
(4)一定压强,将NH3和PH3混合气体降温时,首先液化的物质是
(5)铜、铁元素能形成多种配合物.微粒间形成配位键的条件是:一方是能够提供孤电子对的原子或离子,另一方是具有
查看习题详情和答案>>
(1)第ⅢA、ⅤA元素组成的化合物GaN、GaP、GaAs等是人工合成的新型半导体材料,其晶体结构与单晶硅相似.Ga原子的电子排布式为
1s22s22p63s23p63d104s24p1
1s22s22p63s23p63d104s24p1
.在GaN晶体中,与同一个Ga原子相连的N原子构成的空间构型为正四面体
正四面体
.在四大晶体类型中,GaN属于原子
原子
晶体.(2)NH3分子的空间构型是:
三角锥型
三角锥型
,中心原子N的杂化轨道类型是:sp3
sp3
.(3)NH3与PH3相比,热稳定性更强的是:
NH3
NH3
,理由是:氮的原子半径比磷的原子半径小,N-H键长比P-H键长短,键能更大,分子更稳定
氮的原子半径比磷的原子半径小,N-H键长比P-H键长短,键能更大,分子更稳定
.(4)一定压强,将NH3和PH3混合气体降温时,首先液化的物质是
NH3
NH3
,理由是:因为氨分子之间存在氢键,使分子间作用力更大,沸点更高
因为氨分子之间存在氢键,使分子间作用力更大,沸点更高
.(5)铜、铁元素能形成多种配合物.微粒间形成配位键的条件是:一方是能够提供孤电子对的原子或离子,另一方是具有
能够接受孤电子对的空轨道
能够接受孤电子对的空轨道
的原子或离子.[化学-选修3:物质结构与性质]
砷(As)在地壳中含量不大,但砷的化合物却是丰富多彩.
(1)砷的基态原子的电子排布式为 .
(2)目前市售的发光二极管,其材质以砷化镓(GaAs)为主.Ga和As相比,电负性较大的 是 ,GaAs中Ga的化合价为
(3)AsH3是无色稍有大蒜气味的气体,在AsH3中As原子的杂化轨道类型为 ;AsH3的沸点高于PH3,其主要原因为
(4)Na3As04可作杀虫剂.As043-的立体构型为 与其互为等电子体的分子的化学式为 (任写一种).
(5)H3As04和H3As03是砷的两种含氧酸,请根据结构与性质的关系,解释H3AsO4比 H3AsO3 酸性强的原因 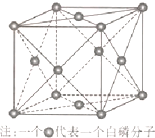
(6)磷与砷同主族,磷的一种单质白磷(P4)属于分子晶体,其晶胞如图.已知最近的两个白磷分子间距离为 a pm,阿伏加德罗常数的值为NA,则该晶体的密度为 g/cm3(只要求列算式,不必计算)
查看习题详情和答案>>
砷(As)在地壳中含量不大,但砷的化合物却是丰富多彩.
(1)砷的基态原子的电子排布式为
(2)目前市售的发光二极管,其材质以砷化镓(GaAs)为主.Ga和As相比,电负性较大的 是
(3)AsH3是无色稍有大蒜气味的气体,在AsH3中As原子的杂化轨道类型为
(4)Na3As04可作杀虫剂.As043-的立体构型为
(5)H3As04和H3As03是砷的两种含氧酸,请根据结构与性质的关系,解释H3AsO4比 H3AsO3 酸性强的原因

(6)磷与砷同主族,磷的一种单质白磷(P4)属于分子晶体,其晶胞如图.已知最近的两个白磷分子间距离为 a pm,阿伏加德罗常数的值为NA,则该晶体的密度为
 由磷酸形成的磷脂及其化合物(如酶)是生命体内细胞的重要组成部分,对调节生命活动起重要作用.例如:植物若缺少了磷,土壤中或叶面上有再多的氮也不能被吸收.磷酸吡醛素是能有效促进植物对氮肥吸收的含磷化合物,其结构如图,试回答:
由磷酸形成的磷脂及其化合物(如酶)是生命体内细胞的重要组成部分,对调节生命活动起重要作用.例如:植物若缺少了磷,土壤中或叶面上有再多的氮也不能被吸收.磷酸吡醛素是能有效促进植物对氮肥吸收的含磷化合物,其结构如图,试回答: