摘要:4.非极性分子和极性分子(1)非极性分子中整个分子电荷分布是均匀的.对称的.极性分子中整个分子的电荷分布不均匀.不对称.(2)判断依据:键的极性和分子的空间构型两方面因素决定.双原子分子极性键→极性分子.如:HCl.NO.CO.非极性键→非极性分子.如:H2.Cl2.N2.O2.多原子分子.都是非极性键→非极性分子.如P4.S8 .有极性键几何结构对称→非极性分子.如:CO2.CS2.CH4.Cl4.几何结构不对称→极性分子.如H2O2.NH3.H2O.
网址:http://m.1010jiajiao.com/timu_id_427939[举报]
在极性分子中,正电荷重心同负电荷重心间的距离称偶极长,通常用d表示.极性分子的极性强弱同偶极长和正(或负)电荷重心的电量(q)有关,一般用偶极矩(μ)来衡量.分子的偶极矩定义为偶极长和偶极上一端电荷电量的乘积,即=d?q,在非极性分子中因正负电荷重心重合,故μ为0.试回答以下问题:
(1)HCl、CS2、H2S、SO2四种分子中μ=0的有
(2)实验测得:μPF3=1.03、μBCl3=0.
①由此可知,PF3分子的空间构型为
②BC13分子的空间构型为
(3)治癌药Pt(NH3)2Cl2具有平面四边形结构,Pt处在四边形中心,NH3和Cl分别处在四边形的4个角上.已知该化合物有两种异构体,棕黄色者μ>0,淡黄色者μ=0.试画出两种异构体的构型图,并比较在水中的溶解度.构型图:淡黄色者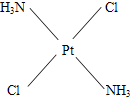
 ,棕黄色者
,棕黄色者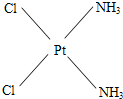
 ;在水中溶解度较大的是
;在水中溶解度较大的是
查看习题详情和答案>>
(1)HCl、CS2、H2S、SO2四种分子中μ=0的有
CS2
CS2
;(2)实验测得:μPF3=1.03、μBCl3=0.
①由此可知,PF3分子的空间构型为
三角锥形
三角锥形
;②BC13分子的空间构型为
平面正三角形
平面正三角形
,中心原子的杂化方式为sp2
sp2
.(3)治癌药Pt(NH3)2Cl2具有平面四边形结构,Pt处在四边形中心,NH3和Cl分别处在四边形的4个角上.已知该化合物有两种异构体,棕黄色者μ>0,淡黄色者μ=0.试画出两种异构体的构型图,并比较在水中的溶解度.构型图:淡黄色者




棕黄色者
棕黄色者
.
在极性分子中,正电荷重心同负电荷重心间的距离称偶极长,通常用d表示.极性分子的极性强弱同偶极长和正(或负)电荷重心的电量(q)有关,一般用偶极矩(μ)来衡量.分子的偶极矩定义为偶极长和偶极上一端电荷电量的乘积,即=d?q,在非极性分子中因正负电荷重心重合,故μ为0.试回答以下问题:
(1)HCl、CS2、H2S、SO2四种分子中μ=0的有 ;
(2)实验测得:μPF3=1.03、μBCl3=0.
①由此可知,PF3分子的空间构型为 ;
②BC13分子的空间构型为 ,中心原子的杂化方式为 .
(3)治癌药Pt(NH3)2Cl2具有平面四边形结构,Pt处在四边形中心,NH3和Cl分别处在四边形的4个角上.已知该化合物有两种异构体,棕黄色者μ>0,淡黄色者μ=0.试画出两种异构体的构型图,并比较在水中的溶解度.构型图:淡黄色者 ,棕黄色者 ;在水中溶解度较大的是 . 查看习题详情和答案>>
(1)HCl、CS2、H2S、SO2四种分子中μ=0的有 ;
(2)实验测得:μPF3=1.03、μBCl3=0.
①由此可知,PF3分子的空间构型为 ;
②BC13分子的空间构型为 ,中心原子的杂化方式为 .
(3)治癌药Pt(NH3)2Cl2具有平面四边形结构,Pt处在四边形中心,NH3和Cl分别处在四边形的4个角上.已知该化合物有两种异构体,棕黄色者μ>0,淡黄色者μ=0.试画出两种异构体的构型图,并比较在水中的溶解度.构型图:淡黄色者 ,棕黄色者 ;在水中溶解度较大的是 . 查看习题详情和答案>>
分子有极性分子和非极性分子之分。下列对极性分子和非极性分子的认识正确的
A、只含非极性键的分子一定是非极性分子
B、含有极性键的分子一定是极性分子
C、非极性分子一定含有非极性键
D、极性分子一定含有极性键
查看习题详情和答案>>