题目内容
在极性分子中,正电荷重心同负电荷重心间的距离称偶极长,通常用d表示.极性分子的极性强弱同偶极长和正(或负)电荷重心的电量(q)有关,一般用偶极矩(μ)来衡量.分子的偶极矩定义为偶极长和偶极上一端电荷电量的乘积,即=d?q,在非极性分子中因正负电荷重心重合,故μ为0.试回答以下问题:
(1)HCl、CS2、H2S、SO2四种分子中μ=0的有
(2)实验测得:μPF3=1.03、μBCl3=0.
①由此可知,PF3分子的空间构型为
②BC13分子的空间构型为
(3)治癌药Pt(NH3)2Cl2具有平面四边形结构,Pt处在四边形中心,NH3和Cl分别处在四边形的4个角上.已知该化合物有两种异构体,棕黄色者μ>0,淡黄色者μ=0.试画出两种异构体的构型图,并比较在水中的溶解度.构型图:淡黄色者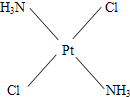
 ,棕黄色者
,棕黄色者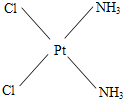
 ;在水中溶解度较大的是
;在水中溶解度较大的是
(1)HCl、CS2、H2S、SO2四种分子中μ=0的有
CS2
CS2
;(2)实验测得:μPF3=1.03、μBCl3=0.
①由此可知,PF3分子的空间构型为
三角锥形
三角锥形
;②BC13分子的空间构型为
平面正三角形
平面正三角形
,中心原子的杂化方式为sp2
sp2
.(3)治癌药Pt(NH3)2Cl2具有平面四边形结构,Pt处在四边形中心,NH3和Cl分别处在四边形的4个角上.已知该化合物有两种异构体,棕黄色者μ>0,淡黄色者μ=0.试画出两种异构体的构型图,并比较在水中的溶解度.构型图:淡黄色者




棕黄色者
棕黄色者
.分析:(1)根据价层电子对互斥模型和题意分析.
(2)根据分子的极性和结构特点(正负电荷重心是否重合)来思考.
(3)根据分子结构和相似相溶解答.
(2)根据分子的极性和结构特点(正负电荷重心是否重合)来思考.
(3)根据分子结构和相似相溶解答.
解答:解:(1)HCl是极性键形成双原子的极性分子.根据价层电子对互斥模型可知,CS2是直线形分子,即非极性分子,其偶极矩为0;H2S、SO2中都是V形,即极性分子,其 μ>0.故 μ=0 的是 CS2,故答案为:CS2;
(2)①μPF3=1.03说明PF3是极性分子,不是非极性分子,即PF3是三角锥形而不是正三角形.故答案为:三角锥形;
②μBCl3=0说明 BCl3 是非极性分子,其正负电荷重心重合,应该是平面正三角形.中心原子B与3个Cl原子形成共价键(没有孤对电子),即B的杂化方式是sp2杂化.故答案为:平面正三角形;sp2;
(3)根据题意,Pt(NH3)2Cl2具有平面四边形结构,若μ=0,则为非极性分子,NH3和Cl分别对称分布在四边形的4个角上,即正负电荷重心重合,故淡黄色者是 ;若μ>0,则为极性分子,NH3和Cl在四边形的4个角上的分布是不对称的,即正负电荷重心不重合,故棕黄色者是
;若μ>0,则为极性分子,NH3和Cl在四边形的4个角上的分布是不对称的,即正负电荷重心不重合,故棕黄色者是 .根据“相似相溶”规律,水是极性分子,因此极性分子的溶质易溶解在水中,即在水中溶解度较大的是棕黄色者,
.根据“相似相溶”规律,水是极性分子,因此极性分子的溶质易溶解在水中,即在水中溶解度较大的是棕黄色者,
故答案为: ;
;  ;棕黄色者.
;棕黄色者.
(2)①μPF3=1.03说明PF3是极性分子,不是非极性分子,即PF3是三角锥形而不是正三角形.故答案为:三角锥形;
②μBCl3=0说明 BCl3 是非极性分子,其正负电荷重心重合,应该是平面正三角形.中心原子B与3个Cl原子形成共价键(没有孤对电子),即B的杂化方式是sp2杂化.故答案为:平面正三角形;sp2;
(3)根据题意,Pt(NH3)2Cl2具有平面四边形结构,若μ=0,则为非极性分子,NH3和Cl分别对称分布在四边形的4个角上,即正负电荷重心重合,故淡黄色者是
 ;若μ>0,则为极性分子,NH3和Cl在四边形的4个角上的分布是不对称的,即正负电荷重心不重合,故棕黄色者是
;若μ>0,则为极性分子,NH3和Cl在四边形的4个角上的分布是不对称的,即正负电荷重心不重合,故棕黄色者是 .根据“相似相溶”规律,水是极性分子,因此极性分子的溶质易溶解在水中,即在水中溶解度较大的是棕黄色者,
.根据“相似相溶”规律,水是极性分子,因此极性分子的溶质易溶解在水中,即在水中溶解度较大的是棕黄色者,故答案为:
 ;
;  ;棕黄色者.
;棕黄色者.点评:本题考查了分子的极性和分子结构、分子性质的关系,具有很强的综合性,属于要求较高的题目.这类题目要求考生审清题目信息,并与所学知识结合起来.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
【物质结构与性质】
决定物质性质的重要因素是物质结构。请回答下列问题。
(1)(2分)CH3+、·CH3、CH3-都是重要的有机反应中间体,有关它们的说法正确的是
| A.它们均由甲烷去掉一个氢原子所得 |
| B.它们的空间构型相同,碳原子均可以采取sp2杂化 |
| C.CH3-与NH3、H3O+互为等电子体,几何构型均为三角锥形 |
| D.CH3+中的碳原子采取sp3杂化,所有原子均共面 |
 量(q)有关,一般用偶极矩(μ)来衡量。分子的偶极矩定义为偶极长和偶极上一端电荷电量的乘积,即μ=d·q。试回答以下问题:
量(q)有关,一般用偶极矩(μ)来衡量。分子的偶极矩定义为偶极长和偶极上一端电荷电量的乘积,即μ=d·q。试回答以下问题:①HCl、CS2、H2S、SO2四种分子中μ=0的是 ;
②实验测得:μPF3
 =1.03、μBCl3=0。由此可知,PF3分子是 构型,BCl3分子是 构型。
=1.03、μBCl3=0。由此可知,PF3分子是 构型,BCl3分子是 构型。(3)(2分)
 对物质的磁性研究表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是__________________。
对物质的磁性研究表明:金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是__________________。(4)(3分)利用光电子能谱证实
 :在洁净铁(可用于合成氨
:在洁净铁(可用于合成氨反应的催化剂)的表面上存在氮原子,右图为氮原子在铁的晶面上的单层附着局部示意图(图中小黑色球代表氮原子,灰色球代表铁原子)。则在单层晶面上N/Fe原子数之比为________________。

(5)(2分)金属晶体的结构可用等径圆球的密堆积来描述,在等径圆球的最密堆积的各种形式中,立方最密堆积和六方最密堆积最为重要,请指出下图中哪个为立方最密堆积 (填“A”或“B”)

图A 图B


