摘要:H2(g)+12 O2 (g) =H2O(l),△H=?285.5kJ?mol?1(3)中和热:在稀溶液中.酸和碱发生中和反应而生成1mol H2O.这时的反应热叫做中和热.
网址:http://m.1010jiajiao.com/timu_id_427904[举报]
已知:H2(g)+ O2(g)=H2O(l) ΔH1=-285.8 kJ·mol-1 ①
O2(g)=H2O(l) ΔH1=-285.8 kJ·mol-1 ①
H2(g)=H2(l) ΔH2=-0.92 kJ·mol-1 ② O2(g)=O2(l) ΔH3=-6.84 kJ·mol-1 ③
H2O(g)=H2O(l) ΔH4=-44 kJ·mol-1 ④
下列说法正确的是
A.上述四个反应都是吸热反应
B.1 mol液态H2的能量大于1 mol气态H2的能量
C.H2的燃烧热(ΔH)为-285.8 kJ·mol-1
D.火箭中液氢燃烧的热化学方程式为H2(l)+ O2(l)=H2O(g) ΔH=-285.8 kJ·mol-1
O2(l)=H2O(g) ΔH=-285.8 kJ·mol-1
查看习题详情和答案>>
工业上用来合成氨的原料之一是氢气,有一种来源是取自石油气,有人设计了以下反应途径,假设反应都能进行,其中最合理的是
[ ]
A. C3H8 C+H2
C+H2
B. C3H8 C3H6+H2
C3H6+H2
C. C3H8+H2O CO+H2
CO+H2
D. C3H8+O2→CO2+H2O;H2O O2+H2
O2+H2
查看习题详情和答案>>
 C+H2
C+H2 B. C3H8
 C3H6+H2
C3H6+H2C. C3H8+H2O
 CO+H2
CO+H2 D. C3H8+O2→CO2+H2O;H2O
 O2+H2
O2+H2 工业上用以合成氨的原料之一 ――氢气,有一种来源是取自石油气。有人设计了以下反应途径,假设反应都能进行,你认为最合理的是
A. C3H8 ![]() C+H2
C+H2
B. C3H![]() C3H6+H2
C3H6+H2
C. C3H8+H2O ![]() CO+H2
CO+H2
D. C3H8+O2 ![]() CO2+H2O H2O
CO2+H2O H2O ![]() H2+O2
H2+O2
 (2013?珠海模拟)甲醇是一种优质燃料,可制作燃料电池.
(2013?珠海模拟)甲醇是一种优质燃料,可制作燃料电池.(1)为探究用 CO2 来生产燃料甲醇的反应原理,现进行如下实验:在体积为 1L 的密闭容器中,充入 1molCO2 和 3molH2,一定条件下发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol
测得 CO2 和 CH3OH(g)的浓度随时间变化如图.请回答:
①从反应开始到平衡,氢气的反应速率:v(H2)=
0.225mol/(L?min)
0.225mol/(L?min)
.②能够说明该反应已达到平衡的是
AC
AC
.A.恒温、恒容时,容器内的压强不再变化
B.恒温、恒容时,容器内混合气体的密度不再变化
C.一定条件下,CO、H2和CH3OH的浓度保持不变
D.一定条件下,单位时间内消耗3molH2的同时生成1mol CH3OH
③下列措施中能使平衡混合物中 n(CH3OH)/n(CO2) 增大的是
CD
CD
.A.加入催化剂
B.充入 He(g),使体系压强增大
C.将 H2O(g)从体系中分离
D.降低温度
④求此温度(t1)下该反应的平衡常数 K1=
5.33
5.33
(计算结果保留三位有效数字).⑤另在温度(t2)条件下测得平衡常数 K2,已知t2>t1,则K2
<
<
K1(填“>”、“=”或“<”).(2)以 CH3OH 为燃料(以 KOH 溶液作电解质溶液)可制成 CH3OH 燃料电池,则充入 CH3OH 的电极为
负
负
极,充入O2电极的反应式为3O2+12e-+6H2O═12OH-(O2+4e-+2H2O═4OH-也算对)
3O2+12e-+6H2O═12OH-(O2+4e-+2H2O═4OH-也算对)
.(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H 1
②2CO(g)+O2(g)═2CO2(g)△H2
则 1mol 甲醇不完全燃烧生成一氧化碳和气态水时反应的△H=
| 1 |
| 2 |
| 1 |
| 2 |
“氢能”将是未来最理想的新能源.
(1)实验测得,1g氢气燃烧生成液态水时放出142.9kJ热量,则氢气燃烧的热化学方程式为 .(填序号)
A.2H2(g)+O2(g)=2H2O(l);△H=-142.9kJ?mol-1
B.H2(g)+
O2(g)=H2O(l);△H=-285.8kJ?mol-1
C.2H2+O2=2H2O(l);△H=-571.6kJ?mol-1
D.H2(g)+
O2(g)=H2O(g);△H=-285.8kJ?mol-1
(2)某化学家根据“原子经济”的思想,设计了如下制备H2的反应步骤
①CaBr2+H2O
CaO+2HBr
②2HBr+Hg
HgBr2+H2
③HgBr2+
④2HgO
2Hg+O2↑
⑤2H2+O2
2H2O
请你根据“原子经济”的思想完成上述步骤③的化学方程式: .并根据“绿色化学”的思想评估该方法制H2的主要缺点: .
(3)利用核能把水分解制氢气,是目前正在研究的课题.如图1是其中的一种流程,其中用了过量的碘.
完成下列反应的化学方程式:反应① ;反应② .此法制取氢气的最大优点是 .
(4)目前有科学家在一定条件下利用水煤气(CO+H2)合成甲醇:
CO(g)+2H2(g)
CH3OH(g).甲醇的物质的量与反应温度的关系如图2所示:
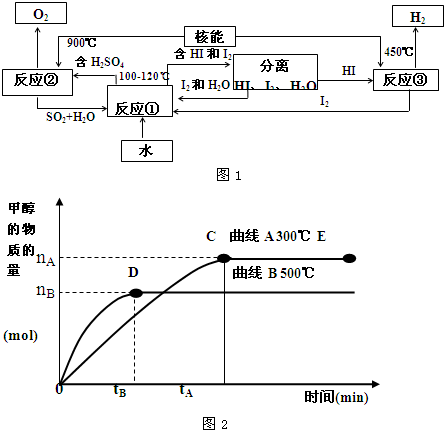
①合成甲醇反应,其反应热△H 0.(填“>”、“<”或“=”)
②其它条件不变,对处于E点的体系体积压缩到原来的
,正反应速率加快,逆反应速率 .(填“加快”、“减慢”、“不变”)重新平衡时
.(填“增大”、“减小”或“不变”)
③据研究,合成甲醇反应体系中通入少量CO2有利于维持催化剂Cu2O的量不变,原因是(用化学方程式表示) .
查看习题详情和答案>>
(1)实验测得,1g氢气燃烧生成液态水时放出142.9kJ热量,则氢气燃烧的热化学方程式为
A.2H2(g)+O2(g)=2H2O(l);△H=-142.9kJ?mol-1
B.H2(g)+
| 1 |
| 2 |
C.2H2+O2=2H2O(l);△H=-571.6kJ?mol-1
D.H2(g)+
| 1 |
| 2 |
(2)某化学家根据“原子经济”的思想,设计了如下制备H2的反应步骤
①CaBr2+H2O
| ||
②2HBr+Hg
| ||
③HgBr2+
| ||
④2HgO
| ||
⑤2H2+O2
| ||
请你根据“原子经济”的思想完成上述步骤③的化学方程式:
(3)利用核能把水分解制氢气,是目前正在研究的课题.如图1是其中的一种流程,其中用了过量的碘.
完成下列反应的化学方程式:反应①
(4)目前有科学家在一定条件下利用水煤气(CO+H2)合成甲醇:
CO(g)+2H2(g)
| CuO/ZnO |

①合成甲醇反应,其反应热△H
②其它条件不变,对处于E点的体系体积压缩到原来的
| 1 |
| 2 |
| c(CH3OH) |
| c(CO) |
③据研究,合成甲醇反应体系中通入少量CO2有利于维持催化剂Cu2O的量不变,原因是(用化学方程式表示)