题目内容
“氢能”将是未来最理想的新能源.
(1)实验测得,1g氢气燃烧生成液态水时放出142.9kJ热量,则氢气燃烧的热化学方程式为 .(填序号)
A.2H2(g)+O2(g)=2H2O(l);△H=-142.9kJ?mol-1
B.H2(g)+
O2(g)=H2O(l);△H=-285.8kJ?mol-1
C.2H2+O2=2H2O(l);△H=-571.6kJ?mol-1
D.H2(g)+
O2(g)=H2O(g);△H=-285.8kJ?mol-1
(2)某化学家根据“原子经济”的思想,设计了如下制备H2的反应步骤
①CaBr2+H2O
CaO+2HBr
②2HBr+Hg
HgBr2+H2
③HgBr2+
④2HgO
2Hg+O2↑
⑤2H2+O2
2H2O
请你根据“原子经济”的思想完成上述步骤③的化学方程式: .并根据“绿色化学”的思想评估该方法制H2的主要缺点: .
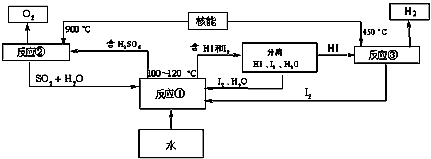
(3)利用核能把水分解制氢气,是目前正在研究的课题.如图1是其中的一种流程,其中用了过量的碘.
完成下列反应的化学方程式:反应① ;反应② .此法制取氢气的最大优点是 .
(4)目前有科学家在一定条件下利用水煤气(CO+H2)合成甲醇:
CO(g)+2H2(g)
CH3OH(g).甲醇的物质的量与反应温度的关系如图2所示:
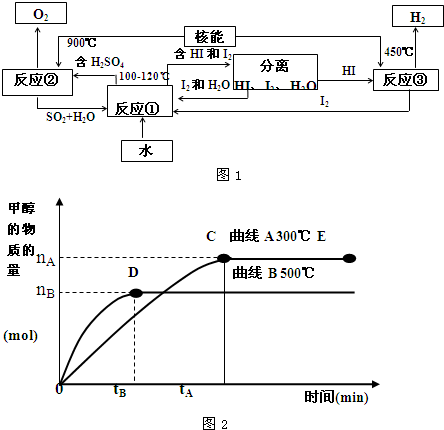
①合成甲醇反应,其反应热△H 0.(填“>”、“<”或“=”)
②其它条件不变,对处于E点的体系体积压缩到原来的
,正反应速率加快,逆反应速率 .(填“加快”、“减慢”、“不变”)重新平衡时
.(填“增大”、“减小”或“不变”)
③据研究,合成甲醇反应体系中通入少量CO2有利于维持催化剂Cu2O的量不变,原因是(用化学方程式表示) .
(1)实验测得,1g氢气燃烧生成液态水时放出142.9kJ热量,则氢气燃烧的热化学方程式为
A.2H2(g)+O2(g)=2H2O(l);△H=-142.9kJ?mol-1
B.H2(g)+
| 1 |
| 2 |
C.2H2+O2=2H2O(l);△H=-571.6kJ?mol-1
D.H2(g)+
| 1 |
| 2 |
(2)某化学家根据“原子经济”的思想,设计了如下制备H2的反应步骤
①CaBr2+H2O
| ||
②2HBr+Hg
| ||
③HgBr2+
| ||
④2HgO
| ||
⑤2H2+O2
| ||
请你根据“原子经济”的思想完成上述步骤③的化学方程式:
(3)利用核能把水分解制氢气,是目前正在研究的课题.如图1是其中的一种流程,其中用了过量的碘.
完成下列反应的化学方程式:反应①
(4)目前有科学家在一定条件下利用水煤气(CO+H2)合成甲醇:
CO(g)+2H2(g)
| CuO/ZnO |

①合成甲醇反应,其反应热△H
②其它条件不变,对处于E点的体系体积压缩到原来的
| 1 |
| 2 |
| c(CH3OH) |
| c(CO) |
③据研究,合成甲醇反应体系中通入少量CO2有利于维持催化剂Cu2O的量不变,原因是(用化学方程式表示)
分析:(1)依据燃烧热概念分析,1mol可燃物完全燃烧生成稳定氧化物放出的热量分析判断;
(2)根据制备氢气的过程消耗的能量和使用了重金属分析
(3)根据反应①②写出反应化学方程式,根据制备氢气的过程使用的物质、能量的消耗、环境的污染污染等方面进行分析.
(4)①由甲醇的物质的量与反应温度的关系图可知温度越高甲醇的物质的量越低来判断水煤气合成甲醇的反应热;
②由容积压缩则压强增大,利用压强对化学反应速率及化学平衡的影响来分析;
③根据Cu2O能被CO还原生成CO2和Cu,该反应为可逆反应;
(2)根据制备氢气的过程消耗的能量和使用了重金属分析
(3)根据反应①②写出反应化学方程式,根据制备氢气的过程使用的物质、能量的消耗、环境的污染污染等方面进行分析.
(4)①由甲醇的物质的量与反应温度的关系图可知温度越高甲醇的物质的量越低来判断水煤气合成甲醇的反应热;
②由容积压缩则压强增大,利用压强对化学反应速率及化学平衡的影响来分析;
③根据Cu2O能被CO还原生成CO2和Cu,该反应为可逆反应;
解答:解:(1)1克氢气燃烧生成液态水放出142.9kJ热量,1moL放出的热量为285.8kJ,燃烧热的热化学方程式中可燃物物质的量为1moL,生成稳定的氧化物,水的状态为液态.热化学方程式为:H2(g)+
O2(g)=H2O(l)△H=-285.8kJ/mol;
故选B.
(2)根据原子经济,可知最终反应为:2H2O═2H2↑+O2↑,根据盖斯定律将(①+②+③)×2+④,可知反应③为HgBr2+CaO
HgO+CaBr2;该方法中需要750℃,消耗能量高,且有重金属污染,
故答案为:HgBr2+CaO
HgO+CaBr2;循环过程需要很高的能量,且使用重金属汞,产生污染;
(3)由制备氢气的过程可知,反应①发生的反应是:SO2+I2+2H2O
H2SO4+2HI,反应②为2H2SO4
2H2O+2SO2↑+O2↑,用该法制取氢气最大的优点是:SO2和I2循环使用,避免了污染环境;
故答为:SO2+I2+2H2O
H2SO4+2HI,2H2SO4
2H2O+2SO2↑+O2↑; SO2和I2循环使用,避免了污染环境.
(4)①由图可知,500℃比300℃达平衡时甲醇的物质的量小,即升高温度化学平衡逆向移动,则正反应为放热反应,△H<0;
故答案为:<;
②由其它条件不变,将E点的容积压缩到原来的1/2,则容积压缩时压强增大,加压时正、逆反应速率都加快,由水煤气合成甲醇的反应可知,
该反应是气体体积缩小的反应,则加压时平衡正向移动,甲醇的物质的量增大,CO的物质的量减小,则c(CH3OH)/c(CO)增大,
故答案为:加快;增大;
③二氧化有利于抑制反应 Cu2O+CO
2Cu+CO2向正反应方向移动,维持Cu2O的量不变,故答案为:Cu2O+CO
2Cu+CO2.
故答案为:Cu2O+CO
Cu+CO2;
| 1 |
| 2 |
故选B.
(2)根据原子经济,可知最终反应为:2H2O═2H2↑+O2↑,根据盖斯定律将(①+②+③)×2+④,可知反应③为HgBr2+CaO
| ||
故答案为:HgBr2+CaO
| ||
(3)由制备氢气的过程可知,反应①发生的反应是:SO2+I2+2H2O
| ||
| ||
故答为:SO2+I2+2H2O
| ||
| ||
(4)①由图可知,500℃比300℃达平衡时甲醇的物质的量小,即升高温度化学平衡逆向移动,则正反应为放热反应,△H<0;
故答案为:<;
②由其它条件不变,将E点的容积压缩到原来的1/2,则容积压缩时压强增大,加压时正、逆反应速率都加快,由水煤气合成甲醇的反应可知,
该反应是气体体积缩小的反应,则加压时平衡正向移动,甲醇的物质的量增大,CO的物质的量减小,则c(CH3OH)/c(CO)增大,
故答案为:加快;增大;
③二氧化有利于抑制反应 Cu2O+CO
| △ |
| △ |
故答案为:Cu2O+CO
| △ |
点评:本题主要考查了燃烧热概念,流程分析应用,新能源氢能的使用,化学平衡影响因素分析判断,难度度不大,在使用新能源时,应避免环境的污染.

练习册系列答案
相关题目
 CaO+2HBr ②2HBr+Hg
CaO+2HBr ②2HBr+Hg HgBr2+H2
HgBr2+H2  HgO+CaBr2 ④2HgO
HgO+CaBr2 ④2HgO 2Hg+O2↑
2Hg+O2↑