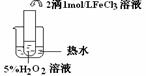
网址:http://m.1010jiajiao.com/timu_id_427900[举报]
(1)化学能与光能的说法不正确的是
A.化石能源是远古太阳能转化为化学能而储存下来的
B.光能转化为化学能最重要的是植物的光合作用
C.利用太阳能分解水制取氢气是光能转化为化学能的过程
D.灯泡通电发光就是灯泡把化学能转化为光能的过程
(2)化学能与热能
已知:①1molH2分子中化学键断裂时需要吸收436kJ的能量
②1molCl2分子中化学键断裂时需要吸收243kJ的能量
③由H原子和Cl原子形成1molHCl分子时释放431kJ的能量.
请写出氢气和氯气反应生成氯化氢气体的热化学方程式是
(3)化学能与电能
①以H2为燃料可制成氢氧燃料电池. 已知2H2(g)+O2(g)═2H2O(l)△H=-572kJ?mol-1
某氢氧燃料电池释放228.8kJ电能时,生成1mol液态水,该电池的能量转化率为
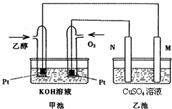
②如图是某笔记本电脑用一个乙醇燃料电池工作时的示意图.乙池中的两个电极均为石墨电极,乙池中盛有100mL 3.00mol/L的CuSO4溶液.
请回答下列问题:
a.通入O2的电极的电极反应式是
b.在此过程中,若乙池中两电极产生的气体恰好相等时(假设标准状况下),理论上需通入
化学是以实验为基础的学科,化学实验又有定性实验和定量实验之分。利用已学知识对下列实验进行分析并填空:
Ⅰ.
| 实验目的 |
| ||
| 实验 |
|
|
|
| 实验结论 | 结论: FeCl3在实验中的作用为: | ||
| 反应方程式 |
| ||
Ⅱ.
| 实验目的 | 探究卤素单质氧化性的相对强弱 | |
| 实验 | 现象 | 离子方程式 |
| 1.将少量氯水分别加入盛有KBr和NaI溶液的试管中,振荡后加入CCl4,振荡、静置 | (1)溶液分层,上层几乎无色,下层为橙色。 (2) | (1) (2) |
| 2.将少量溴水加入盛有NaI溶液的试管中,振荡后加入少量CCl4,振荡、静置 | (3) | |
| 实验结论并从原子结构上解释原因 |
| |
Ⅲ.
资料:氯气难溶于饱和氯化钠溶液;实验室可利用MnO2和浓盐酸在加热的条件下制备氯气
实验:某食盐样品中混有NaBr杂质,为测定该食盐样品的纯度,设计实验过程如甲图所示:

阅读上述资料和实验过程,完成下列填空:
(1)请从下方乙图中选出四个装置(可重复使用),来完成制取并向溶液A中通入过量Cl2的实验,将所选装置的选项代码填入方框,并在括号中写出装置内所放的化学药品。


(2)为了证明甲图中溶液D中几乎不存在Br-,可选用的试剂为 (填选项字母)
A. 碘水 B. 淀粉碘化钾溶液
C. 新制氯水和四氯化碳 D. 食盐水
(3)依据甲图所示,在萃取操作中应选取的有机溶剂为
A. 四氯化碳 B. 水 C. 乙醇 D. 苯
(4)在萃取、分液的过程中,把分液漏斗玻璃塞上的凹槽对准漏斗口上的小孔,其目的是
(5)试计算原固体混合物中氯化钠的质量分数为 %
查看习题详情和答案>>①称取a g样品,置于烧杯中;
②加入适量盐酸和蒸馏水,使样品溶解,然后准确配制成250.00mL溶液;
③量取25.00mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水,使反应完全;
④加入过量氨水,充分搅拌,使沉淀完全;
⑤过滤,洗涤沉淀;
⑥将沉淀转移到某容器内,加热、搅拌,直到固体由红褐色全部变为红棕色后,在干燥器中冷却至室温后,称量;
⑦….
请根据上面叙述,回答:
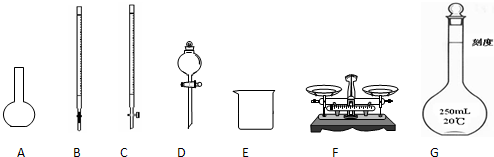
(1)图所示仪器中,本实验步骤①②③中必须用到的仪器是E和
(2)步骤②中加入盐酸的作用
(3)写出步骤④中发生反应的离子方程式
(4)样品中的杂质Fe2+有较强的还原性,完成并配平下列反应的离子方程式
从理论上分析,上述实验中若将氯水改为NaClO3时,对实验结果造成
(5)第⑥步的操作中,将沉淀物转移到
(6)本实验需要称量的最少次数是
| 7(W2-W1) |
| a |
| 7(W2-W1) |
| a |
(7)已知Cl2与热的NaOH溶液可发生如下反应:
3Cl2+6NaOH
| ||
则Fe3+、KClO3、Cl2三种物质其氧化性由强到弱的顺序是
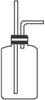
(1)B是用来收集实验中产生的气体的装置,但未将导管画全,请在答题卡上相应图中把导管补充完整。
(2)实验中他们取
①请写出铜跟浓硫酸反应的化学方程式:_____________________。
②为什么有一定量的余酸但未能使铜片完全溶解?你认为原因是:____________________。
③下列药品中能够用来证明反应结束后的烧瓶中确有余酸的是:_________(填写字母编号)。
A.铁粉 B.BaCl2溶液 C.银粉 D.Na2CO3溶液
(3)请设计一个可行的实验方案,来测定余酸的物质的量浓度,简要写出操作步骤及需要测定的数据(不必计算)。
查看习题详情和答案>>1942年我国化工专家侯德榜以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱,“侯氏制碱法”为世界制碱工业做出了突出贡献。有关反应的化学方程式如下:
NH3+CO2+H2O=NH4HCO3,NH4HCO3+NaCl=NaHCO3↓+NH4Cl
2NaHCO3
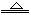 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O(1)“侯氏制碱法”把合成氨和纯碱两种产品联合生产,已知合成氨为放热反应,若从勒夏特列原理来分析,合成氨应选择的温度和压强是 (选填字母)。
a.高温 b.低温 c.常温 d.高压 e.低压 f.常压
(2)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是 (选填字母)
a.碳酸氢钠难溶于水
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(3)某探究活动小组根据上述制碱原理,欲制备碳酸氢钠,同学们按各自设计的方案进行实验。
第一位同学:将二氧化碳气体通人含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中央持、固定用的仪器未画出)。
实验结束后,分离出NaHCO3晶体的操作是 (填分离操作的名称)。
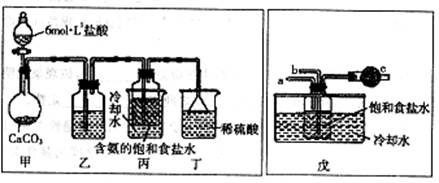
第二位同学:用图中戊装置进行实验(其它装置未画出)。
为提高二氧化碳在此反应溶液中被吸收的程度,实验时,须先从a管通入 气体,再从b管中通入 气体。
(4)请你再写出一种实验室制取少量碳酸氢钠的方法(用相关的化学反应方程式来描述): 。