��Ŀ����
��ѧ�ܵ������ǻ�ѧ�о�����Ҫ���棬��ѧ�ܵ����ð�����ѧ�������ܡ����ܡ����ܵ�ת����
��1����ѧ������ܵ�˵������ȷ����
A����ʯ��Դ��Զ��̫����ת��Ϊ��ѧ�ܶ�����������
B������ת��Ϊ��ѧ������Ҫ����ֲ��Ĺ������
C������̫���ֽܷ�ˮ��ȡ�����ǹ���ת��Ϊ��ѧ�ܵĹ���
D������ͨ�緢����ǵ��ݰѻ�ѧ��ת��Ϊ���ܵĹ���
��2����ѧ��������
��֪����1molH2�����л�ѧ������ʱ��Ҫ����436kJ������
��1molCl2�����л�ѧ������ʱ��Ҫ����243kJ������
����Hԭ�Ӻ�Clԭ���γ�1molHCl����ʱ�ͷ�431kJ��������
��д��������������Ӧ�����Ȼ���������Ȼ�ѧ����ʽ��
��3����ѧ�������
����H2Ϊȼ�Ͽ��Ƴ�����ȼ�ϵ�أ� ��֪2H2��g��+O2��g���T2H2O��l����H=-572kJ?mol-1
ij����ȼ�ϵ���ͷ�228.8kJ����ʱ������1molҺ̬ˮ���õ�ص�����ת����Ϊ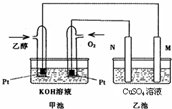
����ͼ��ij�ʼDZ�������һ���Ҵ�ȼ�ϵ�ع���ʱ��ʾ��ͼ���ҳ��е������缫��Ϊʯī�缫���ҳ���ʢ��100mL 3.00mol/L��CuSO4��Һ��
��ش��������⣺
a��ͨ��O2�ĵ缫�ĵ缫��Ӧʽ��
b���ڴ˹����У����ҳ������缫����������ǡ�����ʱ�������״���£�����������ͨ��
��1����ѧ������ܵ�˵������ȷ����
D
D
�����ţ�A����ʯ��Դ��Զ��̫����ת��Ϊ��ѧ�ܶ�����������
B������ת��Ϊ��ѧ������Ҫ����ֲ��Ĺ������
C������̫���ֽܷ�ˮ��ȡ�����ǹ���ת��Ϊ��ѧ�ܵĹ���
D������ͨ�緢����ǵ��ݰѻ�ѧ��ת��Ϊ���ܵĹ���
��2����ѧ��������
��֪����1molH2�����л�ѧ������ʱ��Ҫ����436kJ������
��1molCl2�����л�ѧ������ʱ��Ҫ����243kJ������
����Hԭ�Ӻ�Clԭ���γ�1molHCl����ʱ�ͷ�431kJ��������
��д��������������Ӧ�����Ȼ���������Ȼ�ѧ����ʽ��
H2��g��+Cl2��g���T2HCl��g����H=-183kJ/mol
H2��g��+Cl2��g���T2HCl��g����H=-183kJ/mol
����3����ѧ�������
����H2Ϊȼ�Ͽ��Ƴ�����ȼ�ϵ�أ� ��֪2H2��g��+O2��g���T2H2O��l����H=-572kJ?mol-1
ij����ȼ�ϵ���ͷ�228.8kJ����ʱ������1molҺ̬ˮ���õ�ص�����ת����Ϊ
80%
80%
��
����ͼ��ij�ʼDZ�������һ���Ҵ�ȼ�ϵ�ع���ʱ��ʾ��ͼ���ҳ��е������缫��Ϊʯī�缫���ҳ���ʢ��100mL 3.00mol/L��CuSO4��Һ��
��ش��������⣺
a��ͨ��O2�ĵ缫�ĵ缫��Ӧʽ��
O2+2H2O+4e-�T4OH-
O2+2H2O+4e-�T4OH-
��b���ڴ˹����У����ҳ������缫����������ǡ�����ʱ�������״���£�����������ͨ��
4.6
4.6
���Ҵ�����������1�����ݻ�ʯ��Դ�IJ�����ˮ�ķֽ���������ת��ֲ��Ĺ��������������ת��֪ʶ���ش�
��2�����ݷ�Ӧ�ȵ��ڷ�Ӧ����ܼ���-��������ܼ������
��3���ٵ�ص�����ת����=
��100%��
��a��ȼ�ϵ���У�ͨ�����ļ����������ü��Ϸ��������õ��ӵĻ�ԭ��Ӧ��
b�������ҳ������缫�ĵ缫��Ӧ�������缫�������������ǡ�����ʱת�Ƶĵ�����������ȷ�������Ҵ�������
��2�����ݷ�Ӧ�ȵ��ڷ�Ӧ����ܼ���-��������ܼ������
��3���ٵ�ص�����ת����=
| ʵ�ʲ������� |
| ���۲������� |
��a��ȼ�ϵ���У�ͨ�����ļ����������ü��Ϸ��������õ��ӵĻ�ԭ��Ӧ��
b�������ҳ������缫�ĵ缫��Ӧ�������缫�������������ǡ�����ʱת�Ƶĵ�����������ȷ�������Ҵ�������
����⣺��1��A����ʯ��Դ��Զ��̫����ת��Ϊ��ѧ�ܶ����������ģ�����ʵ�ʣ���A��ȷ��
B��ֲ��Ĺ�������ǽ�����ת��Ϊ��ѧ������Ҫ�ķ�ʽ����B��ȷ��
C������̫���ֽܷ�ˮ��ȡ�����ǹ���ת��Ϊ��ѧ�ܵĹ��̣���C��ȷ��
D������ͨ�緢����ǵ��ݰѵ���ת��Ϊ�����Լ����ܵĹ��̣���D����
��ѡD��
��2����Ӧ��=������ļ��ܼ���Ӧ��ļ���=436kJ?mol-1+243kJ?mol-1-2��431 kJ?mol-1=-183kJ?mol-1����1mol������1mol������Ӧʱ�ų�����Ϊ183kJ����H=-183kJ/mol����������������Ӧ����2mol�Ȼ������壬��Ӧ�ġ�H=-183kJ/mol����H2��g��+Cl2��g���T2HCl��g����H=-183kJ/mol��
�ʴ�Ϊ��H2��g��+Cl2��g���T2HCl��g����H=-183kJ/mol��
��3���ٵ�ص�����ת����=
��100%=
��100%=80%��
�ʴ�Ϊ��80%��
��a��ȼ�ϵ���У�ͨ�����ļ����������ü��Ϸ��������õ��ӵĻ�ԭ��Ӧ���缫��ӦΪO2+2H2O+4e-�T4OH-���ʴ�Ϊ��O2+2H2O+4e-�T4OH-��
b���ҳ���������Ӧ��4OH--4e-�TO2��+2H2O��������Ӧ�����ǣ�Cu2++2e-�TCu��2H++2e-�TH2��
��ͭ����ȫ���ŵ�ʱ��ת�Ƶ�����0.6mol��
��ת��nmol����ʱ�������ϲ�������������ȣ�
�������ϲ�����������ʵ�����ʽ��ʾΪ��0.25n=0.5��n-0.6����
���n=1.2��
���ݷ�ӦC2H6O+3O2�T2CO2+3H2O����ת��12mol����ʱ������C2H6O����Ϊ1mol����ת��1.2mol����ʱ�������������Ҵ�0.1moL��������4.6g��
�ʴ�Ϊ��4.6��
B��ֲ��Ĺ�������ǽ�����ת��Ϊ��ѧ������Ҫ�ķ�ʽ����B��ȷ��
C������̫���ֽܷ�ˮ��ȡ�����ǹ���ת��Ϊ��ѧ�ܵĹ��̣���C��ȷ��
D������ͨ�緢����ǵ��ݰѵ���ת��Ϊ�����Լ����ܵĹ��̣���D����
��ѡD��
��2����Ӧ��=������ļ��ܼ���Ӧ��ļ���=436kJ?mol-1+243kJ?mol-1-2��431 kJ?mol-1=-183kJ?mol-1����1mol������1mol������Ӧʱ�ų�����Ϊ183kJ����H=-183kJ/mol����������������Ӧ����2mol�Ȼ������壬��Ӧ�ġ�H=-183kJ/mol����H2��g��+Cl2��g���T2HCl��g����H=-183kJ/mol��
�ʴ�Ϊ��H2��g��+Cl2��g���T2HCl��g����H=-183kJ/mol��
��3���ٵ�ص�����ת����=
| ʵ�ʲ������� |
| ���۲������� |
| 228.8 | ||
|
�ʴ�Ϊ��80%��
��a��ȼ�ϵ���У�ͨ�����ļ����������ü��Ϸ��������õ��ӵĻ�ԭ��Ӧ���缫��ӦΪO2+2H2O+4e-�T4OH-���ʴ�Ϊ��O2+2H2O+4e-�T4OH-��
b���ҳ���������Ӧ��4OH--4e-�TO2��+2H2O��������Ӧ�����ǣ�Cu2++2e-�TCu��2H++2e-�TH2��
��ͭ����ȫ���ŵ�ʱ��ת�Ƶ�����0.6mol��
��ת��nmol����ʱ�������ϲ�������������ȣ�
�������ϲ�����������ʵ�����ʽ��ʾΪ��0.25n=0.5��n-0.6����
���n=1.2��
���ݷ�ӦC2H6O+3O2�T2CO2+3H2O����ת��12mol����ʱ������C2H6O����Ϊ1mol����ת��1.2mol����ʱ�������������Ҵ�0.1moL��������4.6g��
�ʴ�Ϊ��4.6��
������������һ�����ڵ绯ѧ���Ȼ�ѧ֪ʶ���ۺϿ����⣬Ҫ��ѧ��ע��֪ʶ�����Ӧ�ã��ѶȲ���

��ϰ��ϵ�д�
�����Ŀ
���ʵķ����ǻ�ѧ�о�����Ҫ����֮һ����ѧ�����߾����������ʵ���ɶ����ʽ��з����о������������֣��ڽ����������д�����������̼������������������ͬ����ǣ�������
| A��C60��O3 | B��H2O2��N2O4 | C��H2SO4��H2CO3 | D��Na2SO3��KMnO4 |
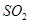 ������___________������ţ���ͬ����
������___________������ţ���ͬ����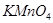 ��Һ�У���Һ����ɫ������ɫ����Ӧ��������Ԫ�ش�����ʽ��������__________
��Һ�У���Һ����ɫ������ɫ����Ӧ��������Ԫ�ش�����ʽ��������__________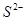 B��
B��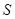 C��
C��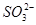 D��
D��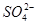
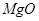 ��
��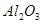 ��
��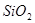 ��
��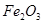 ��ɡ�����
��ɡ�����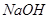 ��Һ�����������ˣ������е���Ҫ�ɷ���_________��
��Һ�����������ˣ������е���Ҫ�ɷ���_________��