网址:http://m.1010jiajiao.com/timu_id_427882[举报]

(1)同学X观察甲中两支试管产生气泡的快慢,由此得出Fe3+和Cu2+对H2O2分解的催化效果,其结论
(2)同学Y利用乙装置探究MnO2对H2O2分解的催化效果.将50mL H2O2一次性加入盛有0.10mol MnO2粉末的烧瓶中,测得标准状况下由量气管读出气体的体积[V(量气管)/mL]和时间(t/min)的关系如丙图所示.
①b
②同学Y除了探究MnO2对H2O2分解速率的影响情况,还可得出
(3)催化剂能加快反应速率,是因为它能改变反应的路径,使发生反应所需的活化能
表一 用MnO2作催化剂
实验序号 | KClO3质量(g) | MnO2质量(g) | 反应温度(℃) | 待测数据 |
1 | 8.00 | 2.00 | 500 |
|
2 | 8.00 | 2.00 | 500 |
|
表二 用A作催化剂
实验序号 | KClO3质量(g) | A质量(g) | 反应温度(℃) | 待测数据 |
1 | 8.00 | 2.00 | 500 |
|
2 | 8.00 | 2.00 | 500 |
|
请回答:
(1)上述实验中的待测数据应是__________。
(2)完成此研究后,他们准备发表一篇研究报告,请你替他们拟一个报告的题目:__________。
(3)催化剂能改变反应速率的原因是________________________________________。
(8分)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,
(1)上图是N2(g)和H2(g)反应生成1mol NH3(g)过程中能量变化示意图,请写出N2和H2反应的热化学方程式: ;
(2)若已知下列数据:
| 化学键 | H-H | N≡N |
| 键能/kJ·mol-1 | 435 | 943 |
试根据表中及图中数据计算N-H的键能 kJ·mol-1
(3)合成氨反应通常用铁触媒作催化剂。使用铁触媒后E1和E2的变化是:E1______,E2______(填“增大”、“减小、”“不变”)。
(4)用NH3催化还原NOX还可以消除氮氧化物的污染。例如
4NH3(g)+3O2(g) 2N2(g)+6H2O(g);△H1= akJ·mol-1
N2(g)+O2(g) 2NO(g);△H2= bkJ/mol
若1mol NH3还原NO至N2,则该反应过程中的反应热△H3= kJ/mol(用含a、b的式子表示)
【解析】(1)根据反应进程可判断反应物的能量高,生成物的能量低,所以热化学方程式为N2(g)+3H2(g)2NH3(g) △H=-92 kJ/mol。
(2)反应热就是断键吸收的能量和成键所放出的能量的差值,所以有943kJ/mol+3×435kJ/mol-2×3×x=-92 kJ/mol ,解得x=390 kJ/mol。
(3)催化剂能降低反应的活化能,但不能改变反应热,所以E1和E2均减小。
(4)考查盖斯定律的应用,将已知的2个热化学方程式叠加即得到
4NH3+6NO=6H2O+5N2 △H=(a-3b)kJ/mol。所以1mol NH3还原NO至N2,则该反应过程中的反应热![]() kJ/mol。
kJ/mol。
查看习题详情和答案>>
(8分)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,
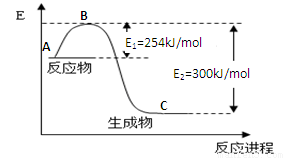
(1)上图是N2(g)和H2(g)反应生成1mol NH3(g)过程中能量变化示意图,请写出N2和H2反应的热化学方程式: ;
(2)若已知下列数据:
|
化学键 |
H-H |
N≡N |
|
键能/kJ·mol-1 |
435 |
943 |
试根据表中及图中数据计算N-H的键能 kJ·mol-1
(3)合成氨反应通常用铁触媒作催化剂。使用铁触媒后E1和E2的变化是:E1______,E2______(填“增大”、“减小、”“不变”)。
(4)用NH3催化还原NOX还可以消除氮氧化物的污染。例如
4NH3(g)+3O2(g) 2N2(g)+6H2O(g)
;△H1= akJ·mol-1
N2(g)+O2(g) 2NO(g);△H2= bkJ/mol
若1mol NH3还原NO至N2,则该反应过程中的反应热△H3= kJ/mol(用含a、b的式子表示)
【解析】(1)根据反应进程可判断反应物的能量高,生成物的能量低,所以热化学方程式为N2(g)+3H2(g) 2NH3(g) △H=-92 kJ/mol。
2NH3(g) △H=-92 kJ/mol。
(2)反应热就是断键吸收的能量和成键所放出的能量的差值,所以有943kJ/mol+3×435 kJ/mol-2×3×x=-92 kJ/mol ,解得x=390 kJ/mol。
(3)催化剂能降低反应的活化能,但不能改变反应热,所以E1和E2均减小。
(4)考查盖斯定律的应用,将已知的2个热化学方程式叠加即得到
4NH3+6NO=6H2O+5N2 △H=(a-3b)kJ/mol。所以1mol NH3还原NO至N2,则该反应过程中的反应热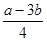 kJ/mol。
kJ/mol。
查看习题详情和答案>>