摘要:6.电子式在元素符号周围用“ ? 或“ × 表示其最外层电子数的式子.(1)用电子式表示阴离子时要用[ ]括起.电荷数写在括号外面的右上角.NH4+.H3O+等复杂阳离子也应如此写.(2)书写简单离子构成的离子化合物的电子式时可以遵循下面几点:①简单阳离子的电子式即是离子符号.②简单阴离子的电子式即是元素符号周围有8个小圆点外加[ ]及电荷数.
网址:http://m.1010jiajiao.com/timu_id_427838[举报]
电子式是指
[ ]
A.用小黑点表示原子核外电子数的式子
B.用小黑点表示原子(或离子)核外电子数的式子
C.用小黑点(或×)表示参与形成化学键的电子数的式子
D.在元素符号周围用小黑点(或×)来表示原子(或离子)最外层电子的式子
查看习题详情和答案>>
B.用小黑点表示原子(或离子)核外电子数的式子
C.用小黑点(或×)表示参与形成化学键的电子数的式子
D.在元素符号周围用小黑点(或×)来表示原子(或离子)最外层电子的式子
电子式是指
- A.用小黑点表示原子核外电子数的式子
- B.用小黑点表示原子(或离子)核外电子数的式子
- C.用小黑点(或×)表示参与形成化学键的电子数的式子
- D.在元素符号周围用小黑点(或×)表示原子(或离子)最外层电子的式子
下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:
(1)元素⑩名称为
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是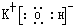
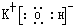 .
.
(3)用电子式表示元素④与⑥的化合物的形成过程:
 ,该化合物属于
,该化合物属于
(4)写出一种由上述元素组成的既有离子键又有非极性共价键的物质的化学式
(5)⑥、⑦、⑨三种元素形成的离子,离子半径由大到小的顺序是
查看习题详情和答案>>
| 主族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
溴
溴
在周期表中的位置第4周期第ⅦA族
第4周期第ⅦA族
.(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是
HClO4
HClO4
,碱性最强的化合物的电子式是: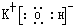
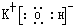
(3)用电子式表示元素④与⑥的化合物的形成过程:


离子
离子
(填“共价”或“离子”)化合物.(4)写出一种由上述元素组成的既有离子键又有非极性共价键的物质的化学式
Na2O2或K2O2
Na2O2或K2O2
.(5)⑥、⑦、⑨三种元素形成的离子,离子半径由大到小的顺序是
S2->Cl->K+
S2->Cl->K+
(用离子符号表示).现有下列短周期元素性质的数据:
回答下列问题:
(1)元素③在周期表中位置是
(2)元素①是
(3)元素⑤与元素②的非金属性强弱顺序为
(4)用电子式表示元素①氢化物的形成过程
 ;写出元素⑦氢化物的电子式
;写出元素⑦氢化物的电子式
 ;写出实验室制元素⑤单质的化学反应方程式
;写出实验室制元素⑤单质的化学反应方程式
查看习题详情和答案>>
| 元素编号 元素性质 |
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径 (10-10m) |
0.74 | 1.02 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 1.43 |
| 最高或最 低化合价 |
+6 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -2 | -3 | -1 | -3 |
(1)元素③在周期表中位置是
第二周期ⅠA族
第二周期ⅠA族
; 元素④与元素⑦相比较,气态氢化物较稳定的是NH3
NH3
(填化学式);(2)元素①是
O
O
(写元素符号),元素⑥是Na
Na
(写元素符号),二者按照原子个数比为1:1形成的化合物与水反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑
2Na2O2+2H2O=4NaOH+O2↑
;(3)元素⑤与元素②的非金属性强弱顺序为
Cl>S
Cl>S
(写元素符号),元素⑤的单质加入到元素②的氢化物的水溶液中,反应的化学方程式为Cl2+H2S=2HCl+S↓
Cl2+H2S=2HCl+S↓
;(4)用电子式表示元素①氢化物的形成过程




MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
| ||
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
.
| ||