网址:http://m.1010jiajiao.com/timu_id_427813[举报]
[化学—选修化学与技术](30分)
Ⅰ.(18分)请选出下列各题中符合题意的选项:
(1)下列污水处理方法只涉及物理变化的是
A.过滤法 B.氧化还原法 C.中和法 D.化学沉淀法
(2)目前下列工艺过程没有直接使用离子交换技术的是
A.硬水的软化 B.电解饱和食盐水制造NaOH
C.电渗析淡化海水 D.海水中提取金属Mg
(3)根据课本的介绍,下列工业生产过程中不需要使用氨水或氨气的是
A.硫酸的工业制法 B.石油的催化裂化
C.硝酸的工业制法 D.侯氏制碱法
Ⅱ.(12分)水处理技术在生产、生活中应用广泛。
(1)含有较多 离子的水称为硬水。硬水加热后产生碳酸盐沉淀的离子方程式为 (写出一个即可)。
(2)将RH型阳离子交换树脂和ROH型阴离子交换树脂串接来软化天然硬水,应先使硬水通过 (填“RH”或“ROH”)型离子交换树脂,原因是 。
(3)通过施加一定压力使水分子通过半透膜而将大分子或离子截留,从而获得纯净水的方法称为 。电渗析法净化水时,使离子通过半透膜的推动力是 。
(4)检验蒸馏水的纯度时,最简单易行的方法是测定水的 。
[化学—选修化学与技术](30分)
Ⅰ.(18分)请选出下列各题中符合题意的选项:
(1)下列污水处理方法只涉及物理变化的是
A.过滤法 B.氧化还原法 C.中和法 D.化学沉淀法
(2)目前下列工艺过程没有直接使用离子交换技术的是
A.硬水的软化 B.电解饱和食盐水制造NaOH
C.电渗析淡化海水 D.海水中提取金属Mg
(3)根据课本的介绍,下列工业生产过程中不需要使用氨水或氨气的是
A.硫酸的工业制法 B.石油的催化裂化
C.硝酸的工业制法 D.侯氏制碱法
Ⅱ.(12分)水处理技术在生产、生活中应用广泛。
(1)含有较多 离子的水称为硬水。硬水加热后产生碳酸盐沉淀的离子方程式为 (写出一个即可)。
(2)将RH型阳离子交换树脂和ROH型阴离子交换树脂串接来软化天然硬水,应先使硬水通过 (填“RH”或“ROH”)型离子交换树脂,原因是 。
(3)通过施加一定压力使水分子通过半透膜而将大分子或离子截留,从而获得纯净水的方法称为 。电渗析法净化水时,使离子通过半透膜的推动力是 。
(4)检验蒸馏水的纯度时,最简单易行的方法是测定水的 。
查看习题详情和答案>>
Ⅰ.(18分)请选出下列各题中符合题意的选项:
(1)下列污水处理方法只涉及物理变化的是
A.过滤法 B.氧化还原法 C.中和法 D.化学沉淀法
(2)目前下列工艺过程没有直接使用离子交换技术的是
A.硬水的软化 B.电解饱和食盐水制造NaOH
C.电渗析淡化海水 D.海水中提取金属Mg
(3)根据课本的介绍,下列工业生产过程中不需要使用氨水或氨气的是
A.硫酸的工业制法 B.石油的催化裂化
C.硝酸的工业制法 D.侯氏制碱法
Ⅱ.(12分)水处理技术在生产、生活中应用广泛。
(1)含有较多 离子的水称为硬水。硬水加热后产生碳酸盐沉淀的离子方程式为 (写出一个即可)。
(2)将RH型阳离子交换树脂和ROH型阴离子交换树脂串接来软化天然硬水,应先使硬水通过 (填“RH”或“ROH”)型离子交换树脂,原因是 。
(3)通过施加一定压力使水分子通过半透膜而将大分子或离子截留,从而获得纯净水的方法称为 。电渗析法净化水时,使离子通过半透膜的推动力是 。
(4)检验蒸馏水的纯度时,最简单易行的方法是测定水的 。
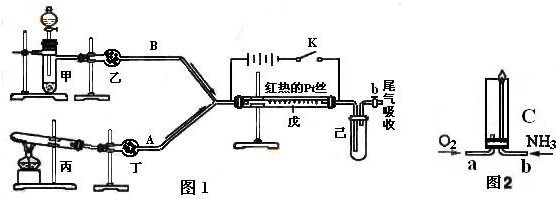
根据图1中装置和反应现象请回答:
(1)若乙中盛有P2O5,此时丙装置中发生反应的化学方程式为
| ||
| ||
(2)检验甲装置气密性的方法
(3)当己中充满红棕色气体后,停止甲、丙装置中的反应,并关闭a、b两个活塞,将己装置浸入冰水中,出现的现象是
(4)已知氨气在纯氧中安静的燃烧,如图2,将过量O2与NH3分别从a、b两管进气口通入到装置C中,并在b管上端点燃氨气.先通入O2,后通过NH3的理由是
(5)液氨与水性质颇为相似,其电离方程式可表示为:2NH3?NH4++NH2-.某温度下其离子积常数为1×10-30(mol?L-1)2.液氨中的pNH4与水中的pH类似,向1L液氨中加入2.3gNa此时上述平衡
(1)化学反应中的△H是以
对于化学反应A+B=C+D,若H(A)+H(B)>H(C)+H(D),则该反应的△H为
(2)进一步研究表明,化学反应的焓变与反应物和生成物的键能有关.
已知:H2(g)+Cl2(g)=2HCl(g)△H=-185kJ?mol-1,△H(H2)=436kJ?mol-1,
△H(Cl2)=247kJ?mol-1.则△H(HCl)=
(3)Hess G.H在总结大量实验事实之后认为,只要化学反应的始态和终态确定,则化学反应的△H便是定值,与反应的途径无关.这就是有名的“Hess定律”.
已知:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-25kJ?mol-1
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=-47kJ?mol-1
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=19kJ?mol-1
请写出CO还原FeO的热化学方程式: