摘要:②每次取1.00g此化肥样品.溶于20mL蒸馏水中,
网址:http://m.1010jiajiao.com/timu_id_41256[举报]
第I卷(选择题)
一、选择题:每小题只有一个正确答案。每小题6分,多选、错选均不给分。
6. C 7. B 8. D 9. B 10. A 11. C 12. A 13. D
26. (15分)
(1).files/image012.gif) ……2分
……2分
(2).files/image013.gif) ……3分
……3分
(3).files/image014.gif) ……3分
……3分
(4).files/image015.gif) ……3分
……3分
(5)负极(2分);.files/image016.gif) ……2分
……2分
27. (15分)
(1)(6分,每空2分)
Na:.files/image017.gif)
.files/image018.gif)
.files/image019.gif) (或其它正确反应)
(或其它正确反应)
(2)(6分,每空3分).files/image020.gif) ;
;.files/image021.gif)
(3)(3分).files/image022.gif)
28. (16分)
(1)(6分,各3分)
以酚酞为指示剂,用1.00mol/L的HCl溶液滴定,达到滴定终点用去V(mL);
.files/image023.gif)
(2)(2分)AC
(3)(3分)减小测定误差,提高测定结果的准确性。
(4)(2分)C
(5)(3分).files/image024.gif)
29. (14分)
(1).files/image025.gif) ……2分
……2分
(2)羟基、羧基(4分,各2分)
(3)
.files/image026.gif)
(4)酯化反应(或取代反应) ……2分
.files/image027.gif)
……3分
三农问题是政府和社会关注的问题,化肥是土地的营养品.某农资商店出售一种化肥,其有效成分为氯化铵,现欲测定该种化肥中氮元素的质量分数,设计实验步骤如下(杂质中不含氮元素,且杂质均不与盐酸或氢氧化钠溶液反应):
①配制1.00mol/L的HCl溶液和1.00mol/L的NaOH溶液;
②每次取1.00g此化肥样品,溶于20mL蒸馏水中;
③加入30.00mL1.00mol/L的NaOH溶液,将反应后的溶液加热煮沸约1分钟,冷却至常温;
④…;
⑤重复②③④步操作1-2次;
⑥记录整理实验所得数据,计算该化肥中氮元素的质量分数.
请回答下列问题:
(1)写出步骤④中的实验内容
(2)下列仪器中,配制盐酸和氢氧化钠溶液都能用到的是
A.玻璃棒 B.托盘天平 C.烧杯 D.漏斗
(3)步骤⑤的实验目的是
(4)配制本实验所需的1.00mol/L的盐酸和1.00mol/L的NaOH溶液从节约化学药品的角度出发,最好应选用的容量瓶规格分别为
A.50mL,50mL B.150mL,100mL C.100mL,150mL D.250mL,500mL
(5)若以Vx(mL)表示实验所测定消耗盐酸数据的平均值,该化肥样品中氮元素的质量分数计算表达式为
×100%
×100%.(不需要化简)
查看习题详情和答案>>
①配制1.00mol/L的HCl溶液和1.00mol/L的NaOH溶液;
②每次取1.00g此化肥样品,溶于20mL蒸馏水中;
③加入30.00mL1.00mol/L的NaOH溶液,将反应后的溶液加热煮沸约1分钟,冷却至常温;
④…;
⑤重复②③④步操作1-2次;
⑥记录整理实验所得数据,计算该化肥中氮元素的质量分数.
请回答下列问题:
(1)写出步骤④中的实验内容
以酚酞为指示剂,用1.00mol/L的HCl溶液滴定,达到滴定终点用去V(mL)
以酚酞为指示剂,用1.00mol/L的HCl溶液滴定,达到滴定终点用去V(mL)
,写出实验步骤④中的离子方程式:OH-+H+═H2O
OH-+H+═H2O
.(2)下列仪器中,配制盐酸和氢氧化钠溶液都能用到的是
AC
AC
A.玻璃棒 B.托盘天平 C.烧杯 D.漏斗
(3)步骤⑤的实验目的是
减小误差,提高实验结果的准确度
减小误差,提高实验结果的准确度
.(4)配制本实验所需的1.00mol/L的盐酸和1.00mol/L的NaOH溶液从节约化学药品的角度出发,最好应选用的容量瓶规格分别为
C
C
(填字母选项).A.50mL,50mL B.150mL,100mL C.100mL,150mL D.250mL,500mL
(5)若以Vx(mL)表示实验所测定消耗盐酸数据的平均值,该化肥样品中氮元素的质量分数计算表达式为
| (30×10-3L×1mol/L-Vx×10-3L×1mol/L)×14g/mol |
| 1g |
| (30×10-3L×1mol/L-Vx×10-3L×1mol/L)×14g/mol |
| 1g |
三农问题是政府和社会关注的问题,化肥是土地的营养品.某农资商店出售一种化肥,其有效成分为氯化铵,现欲测定该种化肥中氮元素的质量分数,设计实验步骤如下(杂质中不含氮元素,且杂质均不与盐酸或氢氧化钠溶液反应):
①配制1.00mol/L的HCl溶液和1.00mol/L的NaOH溶液;
②每次取1.00g此化肥样品,溶于20mL蒸馏水中;
③加入30.00mL1.00mol/L的NaOH溶液,将反应后的溶液加热煮沸约1分钟,冷却至常温;
④…;
⑤重复②③④步操作1-2次;
⑥记录整理实验所得数据,计算该化肥中氮元素的质量分数.
请回答下列问题:
(1)写出步骤④中的实验内容______,写出实验步骤④中的离子方程式:______.
(2)下列仪器中,配制盐酸和氢氧化钠溶液都能用到的是______
A.玻璃棒 B.托盘天平 C.烧杯 D.漏斗
(3)步骤⑤的实验目的是______.
(4)配制本实验所需的1.00mol/L的盐酸和1.00mol/L的NaOH溶液从节约化学药品的角度出发,最好应选用的容量瓶规格分别为______(填字母选项).
A.50mL,50mL B.150mL,100mL C.100mL,150mL D.250mL,500mL
(5)若以Vx(mL)表示实验所测定消耗盐酸数据的平均值,该化肥样品中氮元素的质量分数计算表达式为______.(不需要化简)
查看习题详情和答案>>
三农问题是政府和社会关注的问题,化肥是土地的营养品.某农资商店出售一种化肥,其有效成分为氯化铵,现欲测定该种化肥中氮元素的质量分数,设计实验步骤如下(杂质中不含氮元素,且杂质均不与盐酸或氢氧化钠溶液反应):
①配制1.00mol/L的HCl溶液和1.00mol/L的NaOH溶液;
②每次取1.00g此化肥样品,溶于20mL蒸馏水中;
③加入30.00mL1.00mol/L的NaOH溶液,将反应后的溶液加热煮沸约1分钟,冷却至常温;
④…;
⑤重复②③④步操作1-2次;
⑥记录整理实验所得数据,计算该化肥中氮元素的质量分数.
请回答下列问题:
(1)写出步骤④中的实验内容______,写出实验步骤④中的离子方程式:______.
(2)下列仪器中,配制盐酸和氢氧化钠溶液都能用到的是______
A.玻璃棒 B.托盘天平 C.烧杯 D.漏斗
(3)步骤⑤的实验目的是______.
(4)配制本实验所需的1.00mol/L的盐酸和1.00mol/L的NaOH溶液从节约化学药品的角度出发,最好应选用的容量瓶规格分别为______(填字母选项).
A.50mL,50mL B.150mL,100mL C.100mL,150mL D.250mL,500mL
(5)若以Vx(mL)表示实验所测定消耗盐酸数据的平均值,该化肥样品中氮元素的质量分数计算表达式为______.(不需要化简)
查看习题详情和答案>>
①配制1.00mol/L的HCl溶液和1.00mol/L的NaOH溶液;
②每次取1.00g此化肥样品,溶于20mL蒸馏水中;
③加入30.00mL1.00mol/L的NaOH溶液,将反应后的溶液加热煮沸约1分钟,冷却至常温;
④…;
⑤重复②③④步操作1-2次;
⑥记录整理实验所得数据,计算该化肥中氮元素的质量分数.
请回答下列问题:
(1)写出步骤④中的实验内容______,写出实验步骤④中的离子方程式:______.
(2)下列仪器中,配制盐酸和氢氧化钠溶液都能用到的是______
A.玻璃棒 B.托盘天平 C.烧杯 D.漏斗
(3)步骤⑤的实验目的是______.
(4)配制本实验所需的1.00mol/L的盐酸和1.00mol/L的NaOH溶液从节约化学药品的角度出发,最好应选用的容量瓶规格分别为______(填字母选项).
A.50mL,50mL B.150mL,100mL C.100mL,150mL D.250mL,500mL
(5)若以Vx(mL)表示实验所测定消耗盐酸数据的平均值,该化肥样品中氮元素的质量分数计算表达式为______.(不需要化简)
三农问题是政府和社会关注的问题,化肥是土地的营养品.某农资商店出售一种化肥,其有效成分为氯化铵,现欲测定该种化肥中氮元素的质量分数,设计实验步骤如下(杂质中不含氮元素,且杂质均不与盐酸或氢氧化钠溶液反应):
①配制1.00mol/L的HCl溶液和1.00mol/L的NaOH溶液;
②每次取1.00g此化肥样品,溶于20mL蒸馏水中;
③加入30.00mL1.00mol/L的NaOH溶液,将反应后的溶液加热煮沸约1分钟,冷却至常温;
④…;
⑤重复②③④步操作1-2次;
⑥记录整理实验所得数据,计算该化肥中氮元素的质量分数.
请回答下列问题:
(1)写出步骤④中的实验内容 ,写出实验步骤④中的离子方程式: .
(2)下列仪器中,配制盐酸和氢氧化钠溶液都能用到的是
A.玻璃棒 B.托盘天平 C.烧杯 D.漏斗
(3)步骤⑤的实验目的是 .
(4)配制本实验所需的1.00mol/L的盐酸和1.00mol/L的NaOH溶液从节约化学药品的角度出发,最好应选用的容量瓶规格分别为 (填字母选项).
A.50mL,50mL B.150mL,100mL C.100mL,150mL D.250mL,500mL
(5)若以Vx(mL)表示实验所测定消耗盐酸数据的平均值,该化肥样品中氮元素的质量分数计算表达式为 .(不需要化简) 查看习题详情和答案>>
①配制1.00mol/L的HCl溶液和1.00mol/L的NaOH溶液;
②每次取1.00g此化肥样品,溶于20mL蒸馏水中;
③加入30.00mL1.00mol/L的NaOH溶液,将反应后的溶液加热煮沸约1分钟,冷却至常温;
④…;
⑤重复②③④步操作1-2次;
⑥记录整理实验所得数据,计算该化肥中氮元素的质量分数.
请回答下列问题:
(1)写出步骤④中的实验内容 ,写出实验步骤④中的离子方程式: .
(2)下列仪器中,配制盐酸和氢氧化钠溶液都能用到的是
A.玻璃棒 B.托盘天平 C.烧杯 D.漏斗
(3)步骤⑤的实验目的是 .
(4)配制本实验所需的1.00mol/L的盐酸和1.00mol/L的NaOH溶液从节约化学药品的角度出发,最好应选用的容量瓶规格分别为 (填字母选项).
A.50mL,50mL B.150mL,100mL C.100mL,150mL D.250mL,500mL
(5)若以Vx(mL)表示实验所测定消耗盐酸数据的平均值,该化肥样品中氮元素的质量分数计算表达式为 .(不需要化简) 查看习题详情和答案>>
某农资商店出售一种化肥,其有效成分为氯化铵(杂质中不含氮元素,且杂质均不与盐酸或氢氧化钠溶液反应),现一研究性学习小组欲测定该种化肥中氮元素的质量分数,设计了两种实验方案:
方案一 实验原理:取一定质量该化肥加入足量NaOH溶液并加热,测定产生NH3的质量.现用下列仪器组装一套实验装置:
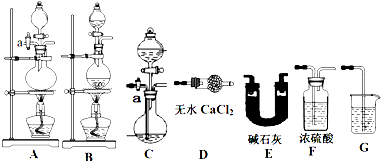
请回答下列问题:
(1)上述装置按气流的连接顺序为(用装置序号表示) .
(2)组装好仪器,检查装置气密性,添加好试剂,关闭活塞a,向装有化肥的容器内加入足量的NaOH溶液然后对容器进行加热,待容器中不再产生气体时,还必须紧接着进行的一步操作是 ,上述操作中若不加热导致实验的最终结果是 .
方案二 设计实验步骤如下:
①配制1.00mol/L的HCl溶液和1.00mol/L的NaOH溶液;
②每次取1.00g此化肥样品,溶于20mL蒸馏水中;
③加入30.00mL1.00mol/L的NaOH溶液,将反应后的溶液加热煮沸约1分钟,冷却至常温;
④以酚酞为指示剂,用1.00mol/L的HCl溶液滴定,达到滴定终点用去V[HCl(aq)]/mL;
⑤重复②③④步操作2次;测得的数据如下表:
⑥记录整理实验所得数据,计算该化肥中氮元素的质量分数.
请回答下列问题:
(3)下列仪器中,配制盐酸和氢氧化钠溶液都能用到的有(填序号) .
A.玻璃棒 B.托盘天平 C.烧杯 D.药题 E.滴定管 F.容量瓶
(4)步骤④中判断滴定终点的方法是 .
(5)步骤⑤的实验目的是 .
(6)该化肥样品中氮元素的质量分数为 .(计算结果保留三位有效数字)
查看习题详情和答案>>
方案一 实验原理:取一定质量该化肥加入足量NaOH溶液并加热,测定产生NH3的质量.现用下列仪器组装一套实验装置:

请回答下列问题:
(1)上述装置按气流的连接顺序为(用装置序号表示)
(2)组装好仪器,检查装置气密性,添加好试剂,关闭活塞a,向装有化肥的容器内加入足量的NaOH溶液然后对容器进行加热,待容器中不再产生气体时,还必须紧接着进行的一步操作是
方案二 设计实验步骤如下:
①配制1.00mol/L的HCl溶液和1.00mol/L的NaOH溶液;
②每次取1.00g此化肥样品,溶于20mL蒸馏水中;
③加入30.00mL1.00mol/L的NaOH溶液,将反应后的溶液加热煮沸约1分钟,冷却至常温;
④以酚酞为指示剂,用1.00mol/L的HCl溶液滴定,达到滴定终点用去V[HCl(aq)]/mL;
⑤重复②③④步操作2次;测得的数据如下表:
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| V[HCl(aq)]/mL | 11.95 | 12.50 | 12.05 |
请回答下列问题:
(3)下列仪器中,配制盐酸和氢氧化钠溶液都能用到的有(填序号)
A.玻璃棒 B.托盘天平 C.烧杯 D.药题 E.滴定管 F.容量瓶
(4)步骤④中判断滴定终点的方法是
(5)步骤⑤的实验目的是
(6)该化肥样品中氮元素的质量分数为