摘要:D.该气体在标准状况下的密度大于2.05g?L-1
网址:http://m.1010jiajiao.com/timu_id_408514[举报]
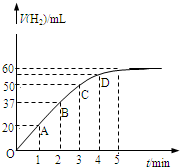 在恒温、恒容的密闭容器中发生如下反应:2HI(g)?H2(g)+I2(g),实验测定,在标准状况下产生氢气的体积和时间的关系如图所示.回答下列问题:
在恒温、恒容的密闭容器中发生如下反应:2HI(g)?H2(g)+I2(g),实验测定,在标准状况下产生氢气的体积和时间的关系如图所示.回答下列问题:(1)A、B、C、D四点对应的化学反应速率由快到慢顺序为
A>B>C>D
A>B>C>D
.(2)解释化学反应速率的大小变化原因
随反应的进行反应物HI的浓度逐渐减小
随反应的进行反应物HI的浓度逐渐减小
.(3)在5min后,收集到的氢气体积不再增加,原因是
该可逆反应达到平衡状态
该可逆反应达到平衡状态
.(4)下列叙述能说明上述反应达到最大限度的是
DE
DE
(填序号)A.HI、H2、I2的物质的量之比为2:1:1
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗2mol HI,同时生成1mol H2
D.混合气体的颜色不随时间的变化而变化
E.HI、H2、I2的生成速率之比为2:1:1.
在25℃,101Kpa下由HCHO(g)、H2和CO组成的混合气体共6.72g,其相对氢气的密度为14,将该气体与足量的氧气(标准状况)充分反应后的产物通过足量的Na202粉末,使Na202粉末增重的质量为 ( )
A.等于6.72g B.小于6.72g
C.大于6.72g D.无法计算
查看习题详情和答案>>|
在25℃,101 Kpa下由HCHO(g)、H2和CO组成的混合气体共6.72 g,其相对氢气的密度为14,将该气体与足量的氧气(标准状况)充分反应后的产物通过足量的Na2O2粉末,使Na2O2粉末增重的质量为 | |
| [ ] | |
A. |
等于6.72 g |
B. |
小于6.72 g |
C. |
大于6.72 g |
D. |
无法计算 |
|
在25℃,101 Kpa下由HCHO(g)、H2和CO组成的混合气体共6.72 g,其相对氢气的密度为14将该气体与2.24 L氧气(标准状况)充分反应后的产物通过足量的Na202粉末,使Na202粉末增重的质量为 | |
A. |
等于6.72 g |
B. |
小于6.72 g |
C. |
大于6.72 g |
D. |
无法计算 |
|
在25℃,101 kPa下由HCHO(g)、H2和CO组成的混合气体共6.72 g,其相对氢气的密度为14,将该气体与2.24 L氧气(标准状况)充分反应后的产物通过足量的Na2O2粉末,使Na2O2粉末增重的质量为 | |
| [ ] | |
A. |
等于6.72 g |
B. |
小于6.72 g |
C. |
大于6.72 g |
D. |
无法计算 |