题目内容
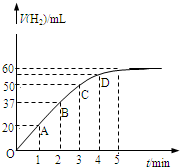 在恒温、恒容的密闭容器中发生如下反应:2HI(g)?H2(g)+I2(g),实验测定,在标准状况下产生氢气的体积和时间的关系如图所示.回答下列问题:
在恒温、恒容的密闭容器中发生如下反应:2HI(g)?H2(g)+I2(g),实验测定,在标准状况下产生氢气的体积和时间的关系如图所示.回答下列问题:(1)A、B、C、D四点对应的化学反应速率由快到慢顺序为
A>B>C>D
A>B>C>D
.(2)解释化学反应速率的大小变化原因
随反应的进行反应物HI的浓度逐渐减小
随反应的进行反应物HI的浓度逐渐减小
.(3)在5min后,收集到的氢气体积不再增加,原因是
该可逆反应达到平衡状态
该可逆反应达到平衡状态
.(4)下列叙述能说明上述反应达到最大限度的是
DE
DE
(填序号)A.HI、H2、I2的物质的量之比为2:1:1
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗2mol HI,同时生成1mol H2
D.混合气体的颜色不随时间的变化而变化
E.HI、H2、I2的生成速率之比为2:1:1.
分析:(1)根据v=
判断反应速率快慢;
(2)反应速率与反应物浓度成正比;
(3)当反应达到平衡状态时收集到的氢气体积不再增加;
(4)反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度等不再发生变化.
| △V |
| △t |
(2)反应速率与反应物浓度成正比;
(3)当反应达到平衡状态时收集到的氢气体积不再增加;
(4)反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度等不再发生变化.
解答:解:(1)根据v=
知,相同时间内,△V随着时间的变化而逐渐减小,所以反应速率逐渐减小,则A、B、C、D四点对应的化学反应速率由快到慢顺序为A>B>C>D,
故答案为:A>B>C>D;
(2)反应速率与反应物浓度成正比,随着反应的减小,HI的浓度逐渐减小,所以其反应速率逐渐减小,
故答案为:随反应的进行反应物HI的浓度逐渐减小;
(3)当反应达到平衡状态时,氢气的正逆反应速率相等,所以氢气体积不再增加,
故答案为:该可逆反应达到平衡状态;
(4)A.HI、H2、I2的物质的量之比为2:1:1时,该反应可能达到平衡状态,也可能未达到平衡状态,与反应物浓度和转化率有关,故错误;
B.无论该反应是否达到平衡状态,混合气体的压强始终不变,故错误;
C.无论该反应是否达到平衡状态,只要单位时间内每消耗2mol HI,就同时生成1mol H2,故错误;
D.当该反应达到平衡状态时,各物质的物质的量不变,所以混合气体的颜色不变,当混合气体的颜色不随时间的变化而变化时,该反应达到平衡状态,故正确;
E.当HI、H2、I2的生成速率之比为2:1:1,该反应达到平衡状态,故正确;
故选DE.
| △V |
| △t |
故答案为:A>B>C>D;
(2)反应速率与反应物浓度成正比,随着反应的减小,HI的浓度逐渐减小,所以其反应速率逐渐减小,
故答案为:随反应的进行反应物HI的浓度逐渐减小;
(3)当反应达到平衡状态时,氢气的正逆反应速率相等,所以氢气体积不再增加,
故答案为:该可逆反应达到平衡状态;
(4)A.HI、H2、I2的物质的量之比为2:1:1时,该反应可能达到平衡状态,也可能未达到平衡状态,与反应物浓度和转化率有关,故错误;
B.无论该反应是否达到平衡状态,混合气体的压强始终不变,故错误;
C.无论该反应是否达到平衡状态,只要单位时间内每消耗2mol HI,就同时生成1mol H2,故错误;
D.当该反应达到平衡状态时,各物质的物质的量不变,所以混合气体的颜色不变,当混合气体的颜色不随时间的变化而变化时,该反应达到平衡状态,故正确;
E.当HI、H2、I2的生成速率之比为2:1:1,该反应达到平衡状态,故正确;
故选DE.
点评:本题考查化学平衡状态的判断、反应速率快慢的判断等知识点,注意该反应是一个反应前后气体体积不变的可逆反应,压强对其只影响反应速率不影响平衡移动,为易错点.

练习册系列答案
相关题目
 2NO2(g) ΔH=+52.70 kJ·mol—1。
2NO2(g) ΔH=+52.70 kJ·mol—1。
 2NO2(g) ΔH=+52.70 kJ·mol—1。
2NO2(g) ΔH=+52.70 kJ·mol—1。