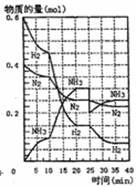
摘要: 500℃.20MPa时.将H2和N2置于一容积为2I.的密闭容器中发生反应.反应过程中H2.N2和NH3物质的量变化如图所示.根据题意完成下列各题:(1) 500℃.20MPa时.反应处于平衡状态的时间 , .(2)反应开始到第一次平衡时.N2的平均反应速率为 .(3)据图判断.反应进行到10min至20min时曲线发生变化的原因是: ,反应进行至25min时.曲线发生变化的原因是: .
网址:http://m.1010jiajiao.com/timu_id_408216[举报]
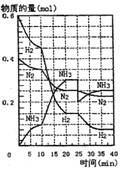
 500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3物质的量变化如图所示,下列说法正确的是( )
500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3物质的量变化如图所示,下列说法正确的是( )| A、反应开始到第一次平衡时,N2的平均反应速率为0.005mol/(L?min) | B、从曲线可以看出,反应进行到10min至20min时可能是使用了催化剂 | C、从曲线可以看出,反应进行至25min时,增加了0.1mol氨气 | D、在25min平衡正向移动但达到新平衡后NH3的体积分数比原平衡小 |
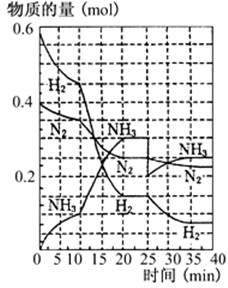
500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应:3H2+N22NH3 △H<0。反应过程中H2、N2和NH3物质的量变化如右图所示,据图判断下列叙述不正确的是

A.反应开始到第一次平衡时,N2的平均反应速率为0.0625 mol·(L·min)-1 ,H2的转化率为75%
B.反应达到第一次平衡时,反应的平衡常数表达式可写作:K=c2(NH3)/[ c3(H2) ·c(N2)]=(0.15 mol·L-1) 2/[ (0.075 mol·L-1) 3 ·(0.125 mol·L-1)]
C.从曲线变化可以看出,反应进行到10min至20min时可能采取的措施是使用了催化剂
D.从曲线变化可以看出,反应进行至25min时,采取的措施是分离出0.1mol的氨气,平衡正向移动
查看习题详情和答案>>
500℃、20Mpa时,将H2和N2置于一容积为2L的密闭容器中发生反应。反应过程中H2、N2和NH3物质的量变化如图所示,下列说法正确的是
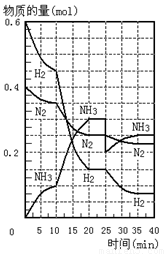
A.反应开始到第一次平衡时,N2的平均反应速率为0.005mol/(L·min)
B.从曲线变化可以看出,反应进行到10min至20min钟时可能是使用了催化剂
C.从曲线变化可以看出,反应进行至25min钟时,分离出0.2mol的氨气
D.在25min钟时平衡正向移动但达到新平衡后 NH3的体积分数比原平衡小
查看习题详情和答案>>