摘要:Ni(CO)4Ni+4CO (4)利用氧化还原反应 把氧气通入H2S水溶液中.H2S被氧化.得硫磺溶胶:
网址:http://m.1010jiajiao.com/timu_id_404818[举报]
 <化学--选修3:物质结构>
<化学--选修3:物质结构>镍(Ni)是一种重要的金属,在材料科学等领域有广泛应用.
(1)Ni在元素周期表中的位置是
(2)镍易形成配合物,如:Ni(CO)4、[Ni(NH3)6]2+ 等.写出一种与配体CO互为等电子体的阴离子
(3)镍常见化合价为+2、+3,在水溶液中通常只以+2 价离子的形式存在.+3价的镍离子具有很强的氧化性,在水中会与水或酸根离子迅速发生氧化还原反应.Ni3+的电子排布式为
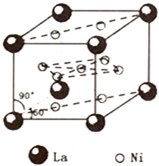
(4)镍和镧(
139 57 |
 第四周期的Cr、Fe、Co、Ni、Cu、Zn等许多金属能形成配合物.
第四周期的Cr、Fe、Co、Ni、Cu、Zn等许多金属能形成配合物.(1)Cr的核外电子排布式为
1s22s22p63s23p63d54s1
1s22s22p63s23p63d54s1
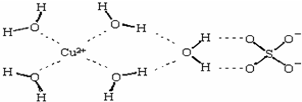
;(2)科学家通过X射线测得胆矾结构示意图可简单表示如下:图中虚线表示的作用力为
氢键、配位键
氢键、配位键
;(3)胆矾溶液与氨水在一定条件下可以生成Cu(NH3)4SO4?H2O晶体.在Cu(NH3)4SO4?H2O晶体中,[Cu(NH3)4]2+ 为平面正方形结构,则呈正四面体结构的原子团是
SO42-
SO42-
,该原子团中心原子的杂化轨道类型是sp3
sp3
;(4)在一定条件下,Cu+比Cu2+稳定,请解释其原因:
Cu+基态离子的价电子排布为3d10,Cu2+基态离子的价电子排布为3d9,前者为半充满,所以Cu+比Cu2+稳定
Cu+基态离子的价电子排布为3d10,Cu2+基态离子的价电子排布为3d9,前者为半充满,所以Cu+比Cu2+稳定
(5)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,呈正四面体构型.试推测四羰基镍的晶体类型是
分子晶体
分子晶体
,Ni(CO)4易溶于BC
BC
.A.水 B.四氯化碳 C.苯 D.硫酸镍溶液.
 (2009?珠海二模)目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位.镍行业发展蕴藏着巨大潜力.
(2009?珠海二模)目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位.镍行业发展蕴藏着巨大潜力.(1)配合物Ni(CO)4常温为液态,易溶于CCl4、苯等有机溶剂.固态Ni(CO)4属于
分子
分子
晶体;基态Ni原子的电子排布式为1s22s22p63s23p63d84s2
1s22s22p63s23p63d84s2
.(2)配合物
 分子内的作用力有
分子内的作用力有ACE
ACE
(填编号).A.氢键 B.离子键 C.共价键 D.配位键
(3)很多不饱和有机物在Ni催化下可以与H2发生加成反应.如①CH2=CH2、②CH≡CH、③
 、④HCHO等,其中碳原子采取sp2杂化的分子有
、④HCHO等,其中碳原子采取sp2杂化的分子有①③④
①③④
(填物质序号),预测HCHO分子的立体结构为平面三角形
平面三角形
形.(4)氢气是新型清洁能源,镧(La)和镍(Ni)的合金可做储氢材料.该合金的晶胞如图所示,晶胞中心有一个镍原子,其他镍原子都在晶胞面上,镧原子都在晶胞顶点.该晶体的化学式
Ni5La
Ni5La
.金属镍及其化合物在合金材料以及催化剂等方面应用广泛.
(1)基态Ni原子的价电子(外围电子)排布式为
(2)金属镍能与CO形成配合物Ni(CO)4,写出与CO互为等电子体的一种分子和一种离子的化学式
(3)很多不饱和有机物在Ni催化下可与H2发生加成反应.如①CH2=CH2、②HC≡CH、③ 、④HCHO其中碳原子采取sp2杂化的分子有
、④HCHO其中碳原子采取sp2杂化的分子有
(4)Ni2+和Fe2+的半径分别为69pm和78pm,则熔点NiO
(5)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图1所示.该合金的化学式为
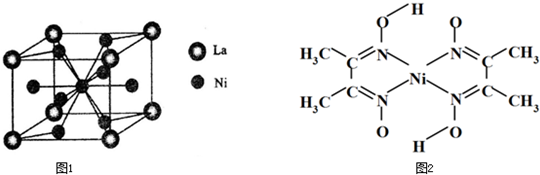
(6)丁二酮肟常用于检验Ni2+:在稀氨水中,丁二酮肟与Ni2+反应生成鲜红色沉淀,其结构如图2所示.该结构中,除共价键外还存在配位键和氢键,请在图中用箭头和“…”表示出配位键和氢键.
查看习题详情和答案>>
(1)基态Ni原子的价电子(外围电子)排布式为
3d84s2
3d84s2
;(2)金属镍能与CO形成配合物Ni(CO)4,写出与CO互为等电子体的一种分子和一种离子的化学式
N2
N2
、CN-
CN-
;(3)很多不饱和有机物在Ni催化下可与H2发生加成反应.如①CH2=CH2、②HC≡CH、③
 、④HCHO其中碳原子采取sp2杂化的分子有
、④HCHO其中碳原子采取sp2杂化的分子有①③④
①③④
(填物质序号),HCHO分子的立体结构为平面三角
平面三角
形;(4)Ni2+和Fe2+的半径分别为69pm和78pm,则熔点NiO
>
>
FeO(填“<”或“>”);(5)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图1所示.该合金的化学式为
LaNi5或Ni5La
LaNi5或Ni5La
;(6)丁二酮肟常用于检验Ni2+:在稀氨水中,丁二酮肟与Ni2+反应生成鲜红色沉淀,其结构如图2所示.该结构中,除共价键外还存在配位键和氢键,请在图中用箭头和“…”表示出配位键和氢键.

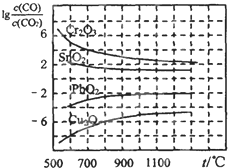 一氧化碳是一种用途相当广泛的化工基础原料.
一氧化碳是一种用途相当广泛的化工基础原料.(1)利用下列反应可以将粗镍转化为纯度达99.9%的高纯镍.
Ni(s)+4CO(g)
| 50~80℃ |
| 180~200℃ |
<
<
0 (选填“>”或“=”或“<”).(2)金属氧化物被一氧化碳还原生成金属单质和二氧化碳.如图是四种金属氧化物(Cr2O3、SnO2、PbO2、Cu2O)被一氧化碳还原时lg
| c(CO) |
| c(CO2) |
| c3(CO2) |
| c3(CO) |
| c3(CO2) |
| c3(CO) |
Cu2O
Cu2O
,800℃时,该反应的平衡常数数值(K)等于106
106
.(3)已知:
①CO(g)+2H2(g)?CH3OH(g)△H=-90.7kJ?mol-1
②2CH3OH(g)?CH3OCH3(g)+H2O(g)△H=-23.5kJ?mol-1
③CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ?mol-1
则3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)的△H=
-246.1kJ/mol
-246.1kJ/mol
.