摘要:aV×10-3mol 0.025×Cmol
网址:http://m.1010jiajiao.com/timu_id_404779[举报]
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
D
D
B
C
C
B
D
A
C
D
D
C
C
A
AD
B
17、3.2 ,D
18、(1)不会,当酚酞变色时的PH值条件下,HCl是与NaOh发生反应,不会与BaCO3作用。
(2)浅红色 无色
(3)不能。因滴定管下方刻度线距活塞处有一定空间,不能测出其所用的滴定液体积
(4)不能 偏高
19、(1)BDCEAF
(2)防止将标准液稀释
(3)偏大
(4)滴定管活塞;锥形瓶中溶液的颜色变化;锥形瓶中溶液的颜色由无色变浅红且保持30秒内不褪色。
(5)偏小 (6)偏大
20、NaOH+HCl====NaCl+H2O
Na2CO3+HCl====NaHCO3+NaCl
NaOH+HCl====NaCl+H2O
Na2CO3+2HCl====2NaCl+CO2↑+H2O;

将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解,产生的NO和NO2混合气体在标准状况下的体积为11.2L,请回答:
(1)NO的体积为
(2)将产生的气体全全释放后,向溶液中加入VmLamol?L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化为沉淀,则原硝酸溶液的浓度为
mol?L-1.
(3)若铜与硝酸刚好反应完全,则原硝酸溶液的浓度为
查看习题详情和答案>>
(1)NO的体积为
5.8
5.8
L,NO2的体积为5.4
5.4
L.(2)将产生的气体全全释放后,向溶液中加入VmLamol?L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化为沉淀,则原硝酸溶液的浓度为
| aV×10-3+0.5 |
| 0.14 |
| aV×10-3+0.5 |
| 0.14 |
(3)若铜与硝酸刚好反应完全,则原硝酸溶液的浓度为
10.86
10.86
mol?L-1.在14.0g银铜合金中加入500mL一定浓度的浓硝酸,合金全部溶解,收集到NO2和NO体积共2.24L(标准状况下),再向该溶液中加入bml,4mol/L的NaOH溶液,刚好使溶液中的阳离子沉淀完全;若将收集到的气体全部与标准状况下的O21.12L充分混合后,通入水中二者刚好完全反应。下列有关说法不正确的的是
A.银的质量为10.8g
B.NO与NO2的体积比之比(相同条件下)为2:1
C.原硝酸的物质的量浓度 (0.1mol+4b×10-3mol)/0.5L
D.沉淀中Cu(OH)2的物质的量为0.05mol
查看习题详情和答案>>
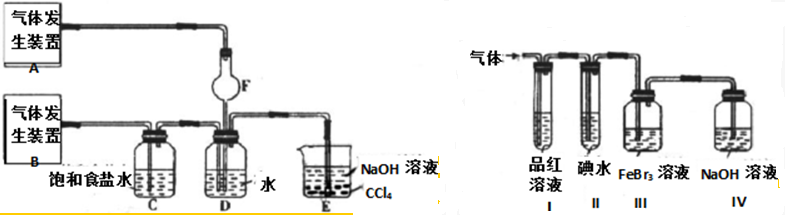
两个研究性学习小组分别进行探究性的实验:
甲组:为了探究Cl2和SO2同时通入H2O中发生的反应,设计了如图1所示的实验装置.
(1)气体发生装置A中产生的气体化学式为 .
(2)装置D中发生反应的化学方程式为 ;在装置D反应后所得溶液中加入BaCl2溶液,观察到的现象是 .
(3)装置C中饱和食盐水的作用是 ;装置E的作用是 .
乙组:为了分别研究SO2和Cl2的性质,设计了如图2所示的实验装置.
(4)若从左端分别通入SO2和Cl2,则装置I中观察到的现象是否相同? (填“相同”或“不相同”);当通入SO2时,装置III中发生反应的离子方程式为 ,该反应中SO2表现出 性.
(5)若装置II中装有5.0mL 1.0×10-3mol?L-1碘水,当通入足量Cl2完全反应后,共转移了5.0×10-5mol电子,则该反应的化学方程式为 .
(6)你认为乙组设计的装置是否有不足之处? (填“有”或“无”).如果有,请写出改进方法: (如果无,此空不答).
 查看习题详情和答案>>
查看习题详情和答案>>
甲组:为了探究Cl2和SO2同时通入H2O中发生的反应,设计了如图1所示的实验装置.
(1)气体发生装置A中产生的气体化学式为
(2)装置D中发生反应的化学方程式为
(3)装置C中饱和食盐水的作用是
乙组:为了分别研究SO2和Cl2的性质,设计了如图2所示的实验装置.
(4)若从左端分别通入SO2和Cl2,则装置I中观察到的现象是否相同?
(5)若装置II中装有5.0mL 1.0×10-3mol?L-1碘水,当通入足量Cl2完全反应后,共转移了5.0×10-5mol电子,则该反应的化学方程式为
(6)你认为乙组设计的装置是否有不足之处?
 查看习题详情和答案>>
查看习题详情和答案>>
 酸、碱、盐都是电解质,在水中都能电离出离子.根据下列化合物:
酸、碱、盐都是电解质,在水中都能电离出离子.根据下列化合物:(1)NaOH(2)CH3COOH(3)NH4Cl(4)NH3?H2O(5)CH3COONa请回答下列问题:(1)上述几种电解质中属于弱电解质的是
(2)(4)
(2)(4)
,溶液呈酸性的有(2)(3)
(2)(3)
(填序号)(2)常温下0.01mol/L NaOH溶液的PH=
12
12
;PH=11的CH3COONa溶液中由水电离产生的c(OH-)=10-3mol/L
10-3mol/L
(3)用离子方程式表示NH4Cl溶液呈酸性的原因
NH4++H2O?NH3?H2O+H+
NH4++H2O?NH3?H2O+H+
,其溶液中离子浓度按由大到小的顺序为c(Cl-)>c(NH4+)>c(H+)>c(OH-)
c(Cl-)>c(NH4+)>c(H+)>c(OH-)
(4)将等PH等体积的NaOH和NH3?H2O分别稀释m倍和n倍,稀释后两溶液的PH仍相等,则m
小于
小于
n (填“大于、等于、小于”)(5)常温下,向100mL 0.01mol?L-1HA溶液中逐滴加入0.02mol?L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).回答下列问题:
①由图中信息可知HA为
强
强
酸(填“强”或“弱”),理由是0.01 mol/LHA的PH=2
0.01 mol/LHA的PH=2
.②K点对应的溶液中,c(M+)+c(MOH)
0.01
0.01
2c(A-)(填“>”、“<”或“=”).(2012?浙江模拟)下表是25°C时某些盐的浓度积常数和弱酸的电离平衡常数,下列说法正确的是( )
|
查看习题详情和答案>>