网址:http://m.1010jiajiao.com/timu_id_404777[举报]
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
D
D
B
C
C
B
D
A
C
D
D
C
C
A
AD
B
17、3.2 ,D
18、(1)不会,当酚酞变色时的PH值条件下,HCl是与NaOh发生反应,不会与BaCO3作用。
(2)浅红色 无色
(3)不能。因滴定管下方刻度线距活塞处有一定空间,不能测出其所用的滴定液体积
(4)不能 偏高
19、(1)BDCEAF
(2)防止将标准液稀释
(3)偏大
(4)滴定管活塞;锥形瓶中溶液的颜色变化;锥形瓶中溶液的颜色由无色变浅红且保持30秒内不褪色。
(5)偏小 (6)偏大
20、NaOH+HCl====NaCl+H2O
Na2CO3+HCl====NaHCO3+NaCl
NaOH+HCl====NaCl+H2O
Na2CO3+2HCl====2NaCl+CO2↑+H2O;

(1)完成并配平离子反应方程式:
(2)请完成相应的实验步骤:
步骤1:称取35.60g草酸三氢钾试样,加水溶解,配成250mL溶液.
步骤2:用移液管量取两份此溶液各25.00mL,分别置于两个锥形瓶中.
步骤3:第1份溶液加硫酸酸化后,用0.1000mol?L-1的高锰酸钾溶液滴定,至滴定终点消耗高锰酸钾溶液12.00mL.
步骤4:在第2份溶液中
(3)根据(2)中的实验步骤回答:
①步骤1用到的实验仪器有:电子天平、药匙、烧杯、玻璃棒、
②如何判断步骤3中的滴定终点?
③3.560g试样中含有还原剂(草酸根)的物质的量共为
(4)热重分析法(TG)是在程序控制温度下,测量物质的质量与温度的关系的一种实验技术.热重分析仪的基本构造由精密天平、程序控温加热炉和记录仪组成;记录仪画出剩余固体质量(m)~炉温(T)曲线,即热重(TG)曲线图.如图为CaC2O4?H2O在N2和O2气氛中的热重曲线.
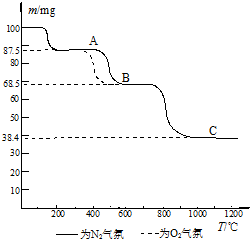
①C点所得固体的化学式为
②CaC2O4?H2O的分解分三个阶段,由图可看出,第二阶段在O2气氛中的反应速率要比在N2气氛中的快,原因是
草酸三氢钾是一种无色晶体或白色粉末,加热至100℃失水成无水物,更高温度时分解为碳酸钾和一氧化碳等,溶于水,微溶于醇.实验室有一KH3(C2O4)2?2H2O样品(混有一定量的H2C2O4和K2SO4).现欲测定其纯度,请回答下列问题:
(1)完成并配平离子反应方程式:
______C2O42-+______MnO4-+______H+=____________+______Mn2++______H2O
(2)请完成相应的实验步骤:
步骤1:称取35.60g草酸三氢钾试样,加水溶解,配成250mL溶液.
步骤2:用移液管量取两份此溶液各25.00mL,分别置于两个锥形瓶中.
步骤3:第1份溶液加硫酸酸化后,用0.1000mol?L-1的高锰酸钾溶液滴定,至滴定终点消耗高锰酸钾溶液12.00mL.
步骤4:在第2份溶液中______,用0.2500mol?L-1NaOH溶液滴定,至滴定终点消耗NaOH溶液20mL.
(3)根据(2)中的实验步骤回答:
①步骤1用到的实验仪器有:电子天平、药匙、烧杯、玻璃棒、______、______等.
②如何判断步骤3中的滴定终点?______.
③3.560g试样中含有还原剂(草酸根)的物质的量共为______.样品纯度为______.
(4)热重分析法(TG)是在程序控制温度下,测量物质的质量与温度的关系的一种实验技术.热重分析仪的基本构造由精密天平、程序控温加热炉和记录仪组成;记录仪画出剩余固体质量(m)~炉温(T)曲线,即热重(TG)曲线图.如图为CaC2O4?H2O在N2和O2气氛中的热重曲线.

①C点所得固体的化学式为______.
②CaC2O4?H2O的分解分三个阶段,由图可看出,第二阶段在O2气氛中的反应速率要比在N2气氛中的快,原因是______(结合化学方程式回答).
查看习题详情和答案>>
(10分)草酸晶体的组成可用H2C2O4·XH2O表示,为了测定x值进行如下实验:
①称取Wg草酸晶体,配成100. mL水溶液
②取25.00mL所配制的草酸溶液置于锥形瓶内,加入适量稀H2SO4后,用浓度amol/L的KMnO4溶液滴定,所发生的反应为:
2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O;
试回答:
(1)实验中不需要的仪器有 (填序号)还缺少的仪器有(填名称) .
a托盘天平(带砝码,镊子) b滴定管 c 100mL量筒 d 100mL容量瓶
e烧杯 f漏斗 g锥形瓶 h玻璃棒 i药匙 j烧瓶 k滴定管夹
(2)实验中KMnO4溶液应装在 式滴定管中,达到滴定终点的现象是
(3)若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,则所测得x值会 (偏大、偏小、无影响)。
(4)在滴定过程中若用去amol/L的KMnO4溶液VmL(已取三次平均值),则所配制的草酸溶液的物质的量浓度为 mol/L,由此可计算X的值是 .
(5)若滴定终点读数时俯视,则计算的X值可能会 (偏大、偏小、无影响)
查看习题详情和答案>>
(10分)草酸晶体的组成可用H2C2O4·XH2O表示,为了测定x值进行如下实验:
①称取Wg草酸晶体,配成100. mL水溶液
②取25.00mL所配制的草酸溶液置于锥形瓶内,加入适量稀H2SO4后,用浓度amol/L的KMnO4溶液滴定,所发生的反应为:
2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O ;
试回答:
(1)实验中不需要的仪器有 (填序号)还缺少的仪器有(填名称) .
a托盘天平(带砝码,镊子) b滴定管 c 100mL量筒 d 100mL容量瓶
e烧杯 f漏斗 g锥形瓶 h玻璃棒 i药匙 j烧瓶 k滴定管夹
(2)实验中KMnO4溶液应装在 式滴定管中,达到滴定终点的现象是
(3)若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,则所测得x值会 (偏大、偏小、无影响)。
(4)在滴定过程中若用去amol/L的KMnO4溶液VmL(已取三次平均值),则所配制的草酸溶液的物质的量浓度为 mol/L,由此可计算X的值是 .
(5)若滴定终点读数时俯视,则计算的X值可能会 (偏大、偏小、无影响)
查看习题详情和答案>>
. 草酸晶体的组成可用H2C2O4·XH2O表示,为了测定x值进行如下实验:
①称取Wg草酸晶体,配成100. mL水溶液
②取25.00mL所配制的草酸溶液置于锥形瓶内,加入适量稀H2SO4后,用浓度amol/L的KMnO4溶液滴定,所发生的反应为:
2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O ;
试回答:
(1)实验中不需要的仪器有 (填序号)还缺少的仪器有(填名称) .
a托盘天平(带砝码,镊子) b滴定管 c 100mL量筒 d 100mL容量瓶
e烧杯 f漏斗 g锥形瓶 h玻璃棒 i药匙 j烧瓶 k滴定管夹
(2)实验中KMnO4溶液应装在 式滴定管中,达到滴定终点的现象是
(3)若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,则所测得x值会 (偏大、偏小、无影响)。
(4)在滴定过程中若用去amol/L的KMnO4溶液VmL(已取三次平均值),则所配制的草酸溶液的物质的量浓度为 mol/L,由此可计算X的值是 .
(5)若滴定终点读数时俯视,则计算的X值可能会 (偏大、偏小、无影响)
查看习题详情和答案>>