网址:http://m.1010jiajiao.com/timu_id_404756[举报]
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
D
D
B
C
C
B
D
A
C
D
D
C
C
A
AD
B
17、3.2 ,D
18、(1)不会,当酚酞变色时的PH值条件下,HCl是与NaOh发生反应,不会与BaCO3作用。
(2)浅红色 无色
(3)不能。因滴定管下方刻度线距活塞处有一定空间,不能测出其所用的滴定液体积
(4)不能 偏高
19、(1)BDCEAF
(2)防止将标准液稀释
(3)偏大
(4)滴定管活塞;锥形瓶中溶液的颜色变化;锥形瓶中溶液的颜色由无色变浅红且保持30秒内不褪色。
(5)偏小 (6)偏大
20、NaOH+HCl====NaCl+H2O
Na2CO3+HCl====NaHCO3+NaCl
NaOH+HCl====NaCl+H2O
Na2CO3+2HCl====2NaCl+CO2↑+H2O;

(⑸题3分,其余每空2分,共15分)四种短周期元素A、D、E、G,原子序数依次增大,A、G同主族,D、E同周期;A和D、E、G的单质都可以在一定条件下化合依次生成共价化合物甲、乙和离子化合物丙,丙和乙剧烈反应得到强碱溶液X和A的单质。请回答:
⑴化合物丙和乙的反应的化学方程式是________________ ;
⑵A和E两种元素构成的一种化合物,其水溶液显弱酸性,试用恰当的方程式解释该溶液呈弱酸性的原因_____________________________________________________ ;
⑶将A、D、E三种元素构成的一种化合物与X恰好反应,所得溶液呈碱性;试用恰当的方程式解释该溶液呈碱性的原因__________________________________________,该溶液中存在的离子有(请用离子符号按浓度由大到小的顺序以“>”连接填写)__________________________________________ ;
⑷在丙和乙的反应中,当转移1.5mol电子时,得到A单质__________ g;若同时得到X的溶液0.50L,则所得溶液的物质的量浓度为__________________________。
⑸工业制取甲的反应为:D2(g)+3A2(g) 2甲(g) ;△H<0 。若改变下列任何一个条件(其它条件不变)时,上述平衡一定向右移动的是(填写序号)_________________ (3分) 。
2甲(g) ;△H<0 。若改变下列任何一个条件(其它条件不变)时,上述平衡一定向右移动的是(填写序号)_________________ (3分) 。
A.将甲不断从反应体系中分离 B.减小反应体系的压强 C.降低反应体系的温度
D.加入适当的催化剂 E.向体系中充入D2和A2
查看习题详情和答案>>
(⑸题3分,其余每空2分,共15分)四种短周期元素A、D、E、G,原子序数依次增大,A、G同主族,D、E同周期;A和D、E、G的单质都可以在一定条件下化合依次生成共价化合物甲、乙和离子化合物丙,丙和乙剧烈反应得到强碱溶液X和A的单质。请回答:
⑴化合物丙和乙的反应的化学方程式是________________ ;
⑵A和E两种元素构成的一种化合物,其水溶液显弱酸性,试用恰当的方程式解释该溶液呈弱酸性的原因_____________________________________________________ ;
⑶将A、D、E三种元素构成的一种化合物与X恰好反应,所得溶液呈碱性;试用恰当的方程式解释该溶液呈碱性的原因__________________________________________,该溶液中存在的离子有(请用离子符号按浓度由大到小的顺序以“>”连接填写)__________________________________________ ;
⑷在丙和乙的反应中,当转移1.5mol电子时,得到A单质__________ g;若同时得到X的溶液0.50L,则所得溶液的物质的量浓度为__________________________。
⑸工业制取甲的反应为:D2(g)+3A2(g) 2甲(g) ;△H<0 。若改变下列任何一个条件(其它条件不变)时,上述平衡一定向右移动的是(填写序号)_________________ (3分) 。
2甲(g) ;△H<0 。若改变下列任何一个条件(其它条件不变)时,上述平衡一定向右移动的是(填写序号)_________________ (3分) 。
A.将甲不断从反应体系中分离 B.减小反应体系的压强 C.降低反应体系的温度
D.加入适当的催化剂 E.向体系中充入D2和A2
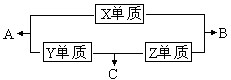 X、Y、Z、W四种短周期元素,其中X、Y、Z的原子序数之和为16,X、Y、Z三种元素的常见单质在常温常压下都是无色气体,在适当的条件下可以发生如下图所示的变化:
X、Y、Z、W四种短周期元素,其中X、Y、Z的原子序数之和为16,X、Y、Z三种元素的常见单质在常温常压下都是无色气体,在适当的条件下可以发生如下图所示的变化:已知一个B分子中含有的Z元素的原子个数比一个C分子中少一个.而W的单质在常温常压下为固体,并且W元素是形成化合物种类最多的元素.请回答下列问题:
(1)元素X在周期表中的位置


(2)化合物C在一定条件下生成化合物A的化学方程式
| ||
| △ |
| ||
| △ |
(3)常温下,将C通入元素Y的最高价氧化物的水化物的水溶液中,恰好完全反应时溶液呈
(4)由X、Y、Z、W四种元素组成的无机酸酸式盐,与足量的NaOH溶液在加热条件下反应的离子方程式为
| ||
| ||
(5)由X、Z、W三种元素可以形成化合物W2Z6X,其蒸汽通过灼热的氧化铜,黑色的氧化铜会逐渐变红,则该反应的化学方程式为
| △ |
| △ |
B、C、D、F四种元素均能与A形成等电子的四种分子,且化合物中各原子的个数比如下表:
化合物 | 甲 | 乙 | 丙 | 丁 |
原子个数比 | B∶A=1∶3 | C∶A=1∶2 | D∶A=1∶1 | F∶A=1∶1 |
(1)C的元素符号为___________,元素F在元素周期表中的位置为___________,化合物乙的分子式___________。
(2)丙在一定条件下可生成单质D2;在101 kPa时,0.5 mol D2与A2完全反应生成液态物质放出的热量为285.8 kJ,该反应的热化学方程式为___________。
(3)0.1 mol/L离子化合物EAB2D4溶液呈弱酸性,则溶液中离子浓度的大小顺序为_________________。
(4)化合物甲的电子式为___________,A、B、C、D四种元素中的某三种能形成多种与甲分子等电子的化合物,请写出其中任意一种化合物的分子式___________。
查看习题详情和答案>>(1)A可以由组成为CnH2n的烃在一定条件下与水加成制得;
(2)B可水解制得A和A氧化后的产物;
(3)C的溶液呈弱酸性,且部分溶于水而使水浑浊,加氢氧化钠溶液后变清;
(4)D能使高锰酸钾酸性溶液褪色,D还可以按1∶4的物质的量比与氢气加成,生成乙基环己烷;
(5)E是片状晶体,易升华,1 mol E完全燃烧需要12 mol氧气,生成4 mol 水;
(6)F是无色晶体,易溶于水,能在一定条件下水解,所生成的两种产物都能发生银镜反应。
根据以上事实判断这六种有机物的结构简式(不能写结构简式的可写分子式)。
查看习题详情和答案>>