网址:http://m.1010jiajiao.com/timu_id_404287[举报]
一、1.D?
2.解析:氮的固定是把单质氮转变成化合物的氮的过程。?
答案:A?
3.B 4.AC?
5.解析:反应消耗灯泡内少许氧气。?
答案:C?
6.B?
7.解析:依反应方程式进行过量与适量的判断后计算。?
答案:B?
8.D 9.C 10.CD 11.C 12.BD?
13.解析:用差量法求解比较方便,但注意2Mg+CO2===2MgO+C,固体物质是两部分。
答案:B?
14.C 15.C?

17.①N2+O2 2NO
2NO
②2NO+O2===2NO2?
③3NO2+H2O===2HNO3+NO↑?
18.①干燥气体 ②使两种气体充分混合,并通过观察气泡以调节氢气、氮气流速 NH3及N2和H2的混合物 用湿润的红色石蕊试纸检验气体,试纸变蓝(或其他合理方法)?
19.(1)N2 NO2 NO NH3 HNO3?
(2)S SO3 SO2 H2S H2SO4?
20.(1)c (2)a (3)检查装置的气密性 本反应为放热反应 (4)将系统内空气排尽 c?
21.(1)无 烧瓶内有红棕色气体?
(2)①单孔塞下沿与液面间不留有空隙(无气泡存在) ②铜丝上有气泡产生?
(3)①当产生的NO气体将稀HNO3排入U型管B侧管内使铜丝网与稀HNO3脱离后反应会立即停止;在U型管A侧管中可观察到无色的NO气体。②U型管的B侧管中的稀HNO3又回到A侧管内,分液漏斗中有红棕色气体出现。
(14分)某化学兴趣小组欲选用下列装置和药品制取纯净乙炔并进行有关乙炔性质的探究,试回答下列问题。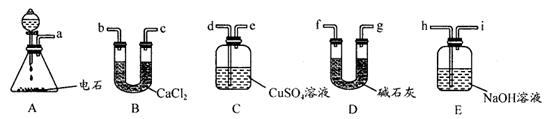
I.(1)A中制取乙炔的化学反应方程式为 : 。
(2)制乙炔时,旋开分液漏斗活塞,使水缓慢滴下的原因是 ;
(3)用电石制的乙炔中常含有H2S、PH3等杂质,除去杂质应选用 (填序号,下同)装置,
气体应从 进;干燥乙炔最好选用 装置。(提示:PH3与CuSO4反应可生成Cu3P沉淀)
Ⅱ.为了探究乙炔与HBr发生加成反应后的有关产物,进行以下实验: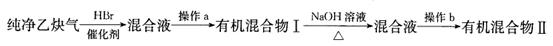
(1)操作b的名称是 ;
(2)有机混合物I可能含有的物质是 (写结构简式)。
(3)最后得到的有机混合物Ⅱ中含两种有机物,其中一种是饱和一元醛,其结构简式为 ;
(14分)某化学兴趣小组欲选用下列装置和药品制取纯净乙炔并进行有关乙炔性质的探究,试回答下列问题。
I.(1)A中制取乙炔的化学反应方程式为 : 。
(2)制乙炔时,旋开分液漏斗活塞,使水缓慢滴下的原因是 ;
(3)用电石制的乙炔中常含有H2S、PH3等杂质,除去杂质应选用 (填序号,下同)装置,
气体应从 进;干燥乙炔最好选用 装置。(提示:PH3与CuSO4反应可生成Cu3P沉淀)
Ⅱ.为了探究乙炔与HBr发生加成反应后的有关产物,进行以下实验:
(1)操作b的名称是 ;
(2)有机混合物I可能含有的物质是 (写结构简式)。
(3)最后得到的有机混合物Ⅱ中含两种有机物,其中一种是饱和一元醛,其结构简式为 ;
查看习题详情和答案>>
(14分)某化学兴趣小组欲选用下列装置和药品制取纯净乙炔并进行有关乙炔性质的探究,试回答下列问题。
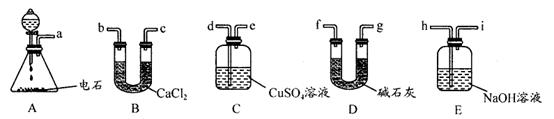
I.(1)A中制取乙炔的化学反应方程式为 : 。
(2)制乙炔时,旋开分液漏斗活塞,使水缓慢滴下的原因是 ;
(3)用电石制的乙炔中常含有H2S、PH3等杂质,除去杂质应选用 (填序号,下同)装置,
气体应从 进;干燥乙炔最好选用 装置。(提示:PH3与CuSO4反应可生成Cu3P沉淀)
Ⅱ.为了探究乙炔与HBr发生加成反应后的有关产物,进行以下实验:
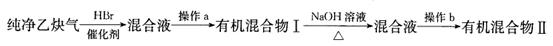
(1)操作b的名称是 ;
(2)有机混合物I可能含有的物质是 (写结构简式)。
(3)最后得到的有机混合物Ⅱ中含两种有机物,其中一种是饱和一元醛,其结构简式为 ;
查看习题详情和答案>>
某化学兴趣小组欲选用下列装置和药品制取纯净乙炔并进行有关乙炔性质的探究,试回答下列问题。
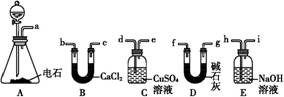
(1)A中制取乙炔的化学方程式为 。
(2)制乙炔时,旋开分液漏斗的活塞,使水缓慢滴下的原因是 。
(3)用电石制得的乙炔中常含有H2S、PH3等杂质,除去杂质应选用 (填序号,下同)装置,气体应从 进;干燥乙炔最好选用 装置。
(4)为了探究乙炔与HBr发生加成反应后的有关产物,进行以下实验:
纯净乙炔气![]() 混合液
混合液![]() 有机混合物Ⅰ
有机混合物Ⅰ![]() 混合液
混合液![]() 有机混合物Ⅱ
有机混合物Ⅱ
①操作b的名称是 ;
②有机混合物Ⅰ可能含有的物质是
(写结构简式)。
查看习题详情和答案>>(1)废水中的N、P元素是造成水体富营养化的关键因素,农药厂排放的废水中常含有较多的NH4+和PO43-,一般可以通过以下两种方法将其除去.
①方法一:将Ca(OH)2或CaO 投加到待处理的废水中,生成磷酸钙,从而进行回收.已知常温下Ksp[Ca3(PO4)2]=2.0×10-33,当处理后的废水中c(Ca2+)=2.0×10-7 mol?L-1时,溶液中c(PO43-)=
②方法二:在废水中加入镁矿工业废水,就可以生成高品位的磷矿石--鸟粪石,反应的方程式为Mg2++NH4++PO43-=MgNH4PO4↓.该方法中需要控制污水的pH为7.5~10.0,若pH高于10.7,鸟粪石的产量会大大降低.其原因可能为
(2)染料工业排放的废水中含有大量有毒的NO2-,可在碱性条件下加入铝粉除去,加热处理后的废水会产生能使湿润的红色石蕊试纸变蓝的气体.现有1.0t含氮质量分数为0.035%的NO2-废水,用此法完全处理后生成的AlO2-的物质的量为
(3)工业上也会利用铝粉除去含氮废水中的NO3-.现在处理100m3浓度为2.0×10-4mol?L-1的NaNO3溶液,加入一定量的2mol?L-1的NaOH溶液和铝粉,控制溶液pH在10.7左右,加热,使产生的气体全部逸出,当NaNO3反应掉一半时,测得氮气和氨气的体积比为4:1,求此过程中消耗铝的质量.(写出计算过程,无过程以0分计算)