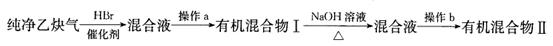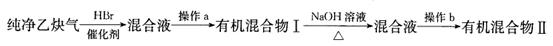题目内容
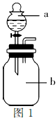
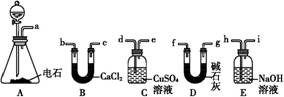
(14分)某化学兴趣小组欲选用下列装置和药品制取纯净乙炔并进行有关乙炔性质的探究,试回答下列问题。
I.(1)A中制取乙炔的化学反应方程式为 : 。
(2)制乙炔时,旋开分液漏斗活塞,使水缓慢滴下的原因是 ;
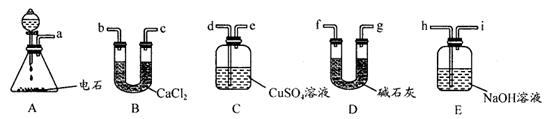
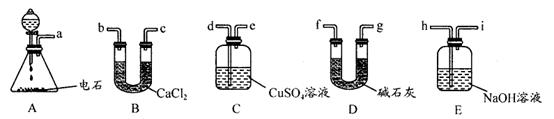
(3)用电石制的乙炔中常含有H2S、PH3等杂质,除去杂质应选用 (填序号,下同)装置,
气体应从 进;干燥乙炔最好选用 装置。(提示:PH3与CuSO4反应可生成Cu3P沉淀)
Ⅱ.为了探究乙炔与HBr发生加成反应后的有关产物,进行以下实验:
(1)操作b的名称是 ;
(2)有机混合物I可能含有的物质是 (写结构简式)。
(3)最后得到的有机混合物Ⅱ中含两种有机物,其中一种是饱和一元醛,其结构简式为 ;
(1)CaC2+2H2O→C2H2↑+Ca(OH)2(2分)
(2)控制反应速率,使产生的气流稳定,避免产生的泡沫进入导管(2分)
(3)C(1分)d(1分)D(1分)
II.(1)分馏(或蒸馏)(2分)
(2)CH2===CHBr(1分)CH3—CHBr2(1分)CH2Br—CH2Br(1分)
(3)CH3CHO(2分)
解析:I.电石与水反应即生成乙炔,方程式为:CaC2+2H2O→C2H2↑+Ca(OH)2。由于电石与水反应很剧烈,所以必须控制反应速率,故使水缓慢滴下。H2S、PH3等具有还原性可以利用CuSO4除去,除杂时应是长口进,短口出。碱石灰的干燥能力强于氯化钙的,故选择碱石灰。
Ⅱ.乙炔与溴化氢加成产物是溴代烃,溴代烃不溶于水可以通过分馏或蒸馏。若乙炔与溴化氢1︰1加成,产物是CH2=CHBr;若乙炔与溴化氢1︰2加成,产物可以是CH3—CHBr2或CH2Br—CH2Br。含有2个碳的饱和一元醛只能是乙醛,结构简式为:CH3CHO。

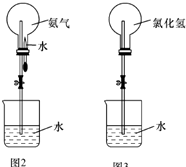 某化学兴趣小组欲制取氨气和氯化氢气体并完成喷泉实验(图中夹持装置均已略去).
某化学兴趣小组欲制取氨气和氯化氢气体并完成喷泉实验(图中夹持装置均已略去).