摘要:反应先后规律在浓度相差不大的溶液中.同时含有几种还原剂时.若加入氧化剂.则它首先与溶液中最强的还原剂作用,同理.在浓度相差不大的溶液中.同时含有几种氧化剂时.若加入还原剂.则它首先与溶液中最强的氧化剂作用.例如.向含有FeBr2溶液中通入Cl2.首先被氧化的是Fe2+ 4.价态归中规律含不同价态同种元素的物质间发生氧化还原反应时.该元素价态的变化一定遵循“高价+低价→中间价 的规律. 5.电子守恒规律在任何氧化―还原反应中.氧化剂得电子总数与还原剂失电子总数一定相等. (1)由元素的金属性或非金属性比较 <1>金属阳离子的氧化性随其单质还原性的增强而减弱
网址:http://m.1010jiajiao.com/timu_id_404111[举报]
A、B、C是中学常见的无机物,且各由两种元素组成;甲、乙、丙是三种常见的单质。这些化合物和单质间存在如图所示的转化关系(这些转化都不需要使用催化剂)。回答下列问题:
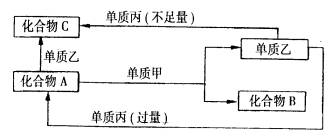
(1)若甲在转化中为氧化剂,是常见非金属气态单质,丙是常见金属,甲、乙、丙中只有甲由短周期元素组成,乙的组成元素与甲的组成元素同主族,与丙的组成元素同周期,乙也有强氧化性,且反应都是在通常条件下的溶液中进行,则:
①甲是 (填化学式,下同);丙是 ;
②A与乙反应的离子方程式是 ;
③当A与甲的物质的量之比为2:3时,A与甲恰好完全反应,且符合图中所示的转化关系,则反应的离子方程式是 ;(2)若甲在转化中是还原剂,是常见活泼金属单质;乙是常见非金属固态单质,且甲、乙、丙都是由短周期元素组成。则甲是 (填化学式,下同);乙是 ;丙是 。
(1)钢铁容易生锈的主要原因是因为钢铁在炼制过程中混有少量的碳杂质,在潮湿的空气中容易形成原电池,发生电化学腐蚀.在空气酸度不大的环境中,该原电池的负极是
(2)下列装置中,能对Fe片腐蚀起防护作用的有(用序号表示)
查看习题详情和答案>>
Fe
Fe
,负极反应式为2Fe-4e-═2Fe2+
2Fe-4e-═2Fe2+
;正极是C
C
,正极反应式为O2+2H2O+4e-═4OH-
O2+2H2O+4e-═4OH-
.(2)下列装置中,能对Fe片腐蚀起防护作用的有(用序号表示)
(3)(4)
(3)(4)
.
高铁酸钾(K2FeO4)是铁的一种重要化合物,具有极强的氧化性.
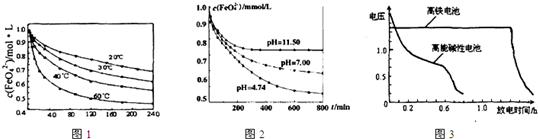
(1)将适量K2FeO4溶解于pH=4.74的溶液中,配制成c(FeO42-)=1.0×10-3mol?L-的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)随时间变化的结果如图1所示.
该实验的目的是
(2)将适量K2FeO4分别溶解于pH=4.74、7.00、11.50的水溶液中,配制成c(FeO42-)=1.0×10-3 mol?L-的试样,静置,考察不同初始pH的水溶液对K2FeO4某种性质的影响,其变化图象见图2,800min时,在pH=11.50的溶液中,K2FeO4的浓度比在pH=4.74的溶液中高,主要原因是
(3)电解法是工业上制备K2FeO4的一种方法.以铁为阳极电解氢氧化钠溶液,然后在阳极溶液中加入KOH,即在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),说明
(4)与MnO2-Zn电池类似,K2FeO4-Zn也可以组成高铁电池,K2FeO4在电池中作正极材料,其电极反应式为FeO42-+3eˉ+4H2O→Fe(OH)3+5OHˉ,则该电池总反应的离子方程式为
查看习题详情和答案>>

(1)将适量K2FeO4溶解于pH=4.74的溶液中,配制成c(FeO42-)=1.0×10-3mol?L-的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)随时间变化的结果如图1所示.
该实验的目的是
探究温度对FeO42-影响(温度越高,高铁酸钾越不稳定)
探究温度对FeO42-影响(温度越高,高铁酸钾越不稳定)
;FeO42-发生反应的△H>
>
0(填“>”“<”或“=”)(2)将适量K2FeO4分别溶解于pH=4.74、7.00、11.50的水溶液中,配制成c(FeO42-)=1.0×10-3 mol?L-的试样,静置,考察不同初始pH的水溶液对K2FeO4某种性质的影响,其变化图象见图2,800min时,在pH=11.50的溶液中,K2FeO4的浓度比在pH=4.74的溶液中高,主要原因是
pH=11.50时溶液中OHˉ离子浓度大,不利于K2FeO4与水的反应正向进行
pH=11.50时溶液中OHˉ离子浓度大,不利于K2FeO4与水的反应正向进行
.(3)电解法是工业上制备K2FeO4的一种方法.以铁为阳极电解氢氧化钠溶液,然后在阳极溶液中加入KOH,即在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),说明
同温度下,高铁酸钾的溶解度比高铁酸钠的溶解度小
同温度下,高铁酸钾的溶解度比高铁酸钠的溶解度小
.电解时阳极发生反应生成FeO42-,该电极反应式为Fe+8OHˉ-6eˉ=FeO42-+4H2O
Fe+8OHˉ-6eˉ=FeO42-+4H2O
.(4)与MnO2-Zn电池类似,K2FeO4-Zn也可以组成高铁电池,K2FeO4在电池中作正极材料,其电极反应式为FeO42-+3eˉ+4H2O→Fe(OH)3+5OHˉ,则该电池总反应的离子方程式为
3Zn+2FeO42-+8H2O=3Zn(OH)2+2Fe(OH)3+4OHˉ
3Zn+2FeO42-+8H2O=3Zn(OH)2+2Fe(OH)3+4OHˉ
.如图3为高铁酸钾电池和高能碱性电池放电曲线,由此可得出的高铁酸钾电池的优点有放电时间长
放电时间长
、工作电压稳定
工作电压稳定
. 某课外活动小组对甲酸进行了如下的实验,以验证其含有醛基,并考察其化学性质.首先做了银镜反应:
某课外活动小组对甲酸进行了如下的实验,以验证其含有醛基,并考察其化学性质.首先做了银镜反应:(1)取少量甲酸加入NaOH溶液中和其酸性,反应的离子方程式为
HCOOH+OH-→HCOO-+H2O
HCOOH+OH-→HCOO-+H2O
.(2)在(1)的溶液中加入银氨溶液,加热,产生了光亮银镜,该小组同学很成功的做了银镜反应,他肯定没有进行的操作
BCD
BCD
(写字母):A、用洁净的试管
B、向银氨溶液中加入硝酸酸化
C、用前几天配制好的银氨溶液
D、在浓度为2%的NH3?H2O中滴入稍过量的浓度为2%的硝酸银
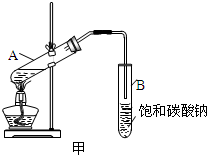
然后,同学们对甲酸与乙醇的酯化反应进行了研究,按下图装置进行实验:
(3)写出
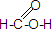 和CH3CH2-18OH进行酯化反应的化学方程式
和CH3CH2-18OH进行酯化反应的化学方程式HCOOH+CH3CH218OH
HCO18OCH2CH3+H2O
| 浓H2SO4 |
| 加热 |
HCOOH+CH3CH218OH
HCO18OCH2CH3+H2O
.| 浓H2SO4 |
| 加热 |
(4)实验中饱和碳酸钠溶液的作用是
吸收乙酸,溶解乙醇,降低甲酸乙酯溶解度,有利于分层
吸收乙酸,溶解乙醇,降低甲酸乙酯溶解度,有利于分层
.从饱和碳酸钠溶液中分离出酯需要用到的主要实验仪器是分液漏斗
分液漏斗
.(5)一同学用装有饱和氢氧化钠的试管接收甲酸乙酯,几乎没有收集到产物,请给予合理的解释
甲酸乙酯在NaOH溶液中发生较彻底的水解
甲酸乙酯在NaOH溶液中发生较彻底的水解
.