摘要:⑴N2O5 N2O3 ⑵2Li+2H2O=2LiOH+H2↑ ⑶PH3<NH3
网址:http://m.1010jiajiao.com/timu_id_403976[举报]
 有些化学反应的化学能能直接转化成电能
有些化学反应的化学能能直接转化成电能Ⅰ.利用Fe+CuSO4=FeSO4+Cu反应,设计一个原电池:
(1)在右框中画出装置图(标明电解质溶液、正、负极和电极材料);
(2)下列说法中,正确的是
B、D
B、D
.(填字母)A.电解质溶液中阳离子向负极移动 B.电子通过外导线由负极流向正极
C.当导线中有1mol电子通过时,理论上正极放出1g气体
D.若所选电极的质量相等,理论上两极质量差为60g,导线中有1mol电子通过
Ⅱ.三套装置如图所示,A、B、C烧杯中分别盛有相同物质的量浓度的稀硫酸.
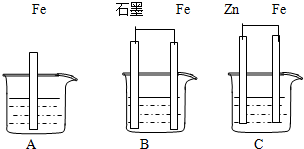
(1)比较A、B、C中铁被腐蚀的速率,由快到慢的顺序为
B、A、C
B、A、C
;(2)若C中电解质溶液是氯化钠溶液,则Fe电极的电极反应式为
O2+2H2O+4e-=4OH-
O2+2H2O+4e-=4OH-
;Ⅲ.目前常用的镍(Ni)镉(Cd)电池,其电池总反应可以表示为:Cd+2NiO(OH)+2H2O
| 放电 | 充电 |
已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸.
(1)以下说法中正确的是
②④
②④
.①以上反应是可逆反应;
②以上反应不是可逆反应;
③充电时化学能转变为电能;
④放电时化学能转变为电能.
(2)废弃的镍镉电池已成为重要的环境污染物,资料表明一节废镍镉电池可以使一平方米面积的耕地失去作用价值.在酸性土壤中这种污染特别严重,这是因为
Ni(OH)2、Cd(OH)2可被酸溶解,生成Ni2+和Cd2+
Ni(OH)2、Cd(OH)2可被酸溶解,生成Ni2+和Cd2+
(3)另一种常用的电池是锂电池,锂是一种碱金属元素,其相对原子质量为7,由于它的比容量(单位质量电极材料所能转换的电量)特别大而广泛应用于心脏起搏器,一般使用时间可长达十年,它的负极用金属锂制成,电池总反应可表示为Li+MnO2=LiMnO2.
锂电池中的电解质溶液需用非水溶剂配制,为什么这种电池不能使用电解质的水溶液
2Li+2H2O═2LiOH+H2↑
2Li+2H2O═2LiOH+H2↑
(请用化学方程式表示其原因).化学电池在日常生活中有着广泛的应用.
(1)目前常用的镍(Ni)镉(Cd)电池,其电池总反应可以表示为:
Cd+2NiO(OH)+2H2O
2Ni(OH)2+Cd(OH)2
已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,以下说法中正确的是
①以上电池反应是在非水溶液中进行的 ②以上电池反应是在强碱溶液中进行的
③以上电池反应不需要电解质就能进行 ④电池工作时是化学能转变为电能
A.①③B.②④C.①④D.②③
(2)另一种常用的电池是锂电池由于它的容量特别大而广泛应用于心脏起搏器,一般使用时间可长达十年.电池总反应可表示为:Li+MnO2=LiMnO2,它的负极材料是
(3)铅蓄电池是典型的可充型电池,电池总反应式为:
Pb+PbO2+4H++2SO
2PbSO4+2H2O
放电时电解液中H2SO4的浓度将变
(4)随着人们生活质量的不断提高,废弃的电池必须进行集中处理的问题被提到议事日程,其首要原因是
查看习题详情和答案>>
(1)目前常用的镍(Ni)镉(Cd)电池,其电池总反应可以表示为:
Cd+2NiO(OH)+2H2O
| 放电 |
| 充电 |
已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,以下说法中正确的是
B
B
.①以上电池反应是在非水溶液中进行的 ②以上电池反应是在强碱溶液中进行的
③以上电池反应不需要电解质就能进行 ④电池工作时是化学能转变为电能
A.①③B.②④C.①④D.②③
(2)另一种常用的电池是锂电池由于它的容量特别大而广泛应用于心脏起搏器,一般使用时间可长达十年.电池总反应可表示为:Li+MnO2=LiMnO2,它的负极材料是
锂
锂
,电极反应式为Li-e-=Li+
Li-e-=Li+
;锂电池中的电解质溶液需用非水溶剂配制,其原因用化学方程式表示为2Li+2H2O=2LiOH+H2↑
2Li+2H2O=2LiOH+H2↑
.(3)铅蓄电池是典型的可充型电池,电池总反应式为:
Pb+PbO2+4H++2SO
2- 4 |
| 放电 |
| 充电 |
放电时电解液中H2SO4的浓度将变
小
小
;当外电路通过1mol电子时,理论上负极板的质量增加48
48
g.(4)随着人们生活质量的不断提高,废弃的电池必须进行集中处理的问题被提到议事日程,其首要原因是
防止电池中的汞、镉和铅等重金属离子对土壤和水源的污染
防止电池中的汞、镉和铅等重金属离子对土壤和水源的污染
.加热N2O5时,发生以下两个分解反应:N2O5?N2O3+O2,N2O3?N2O+O2,在1L密闭容器中加热 4mol N2O5达到化学平衡时c(O2)为4.50mol/L,c(N2O3)为1.62mol/L,则在该温度下各物质的平衡浓度正确的是( )
查看习题详情和答案>>
下表是元素周期表的一部分.
(1)表中元素⑩的氢化物的化学式为
(2)某元素是空气中含量最多的元素,则该元素的元素符号是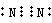
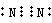 .
.
(3 已知某些不同族元素的性质也有一定的相似性,如元素③与元素⑧的氢氧化物有相似的性质.写出元素③的氢氧化物与NaOH溶液反应的化学方程式
又如表中与元素⑦的性质相似的不同族、不同周期元素X是
查看习题详情和答案>>
| 族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 1 | ① | ||||||
| 2 | ② | ③ | ④ | ⑤ | ⑥ | ||
| 3 | ⑦ | ⑧ | ⑨ | ⑩ | |||
HCl
HCl
,此氢化物的还原性比元素⑨的氢化物的还原性弱
弱
(填强或弱)(2)某元素是空气中含量最多的元素,则该元素的元素符号是
N
N
,其单质的电子式为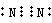
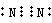
(3 已知某些不同族元素的性质也有一定的相似性,如元素③与元素⑧的氢氧化物有相似的性质.写出元素③的氢氧化物与NaOH溶液反应的化学方程式
Be(OH)2+2NaOH═Na2BeO2+2H2O
Be(OH)2+2NaOH═Na2BeO2+2H2O
,又如表中与元素⑦的性质相似的不同族、不同周期元素X是
Li
Li
(填元素符号),预测X单质与冷水反应的化学方程式2Li+2H2O═2LiOH+H2↑
2Li+2H2O═2LiOH+H2↑
.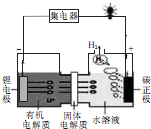 我国科学家发明的一种可控锂水电池的工作原理如图所示.下列有关说法不正确的是( )
我国科学家发明的一种可控锂水电池的工作原理如图所示.下列有关说法不正确的是( )