摘要:⑴D,A,B,F→B→A→C→D→E ⑵2Cl--2e==Cl2↑,变蓝色 Cl2+2I-==2Cl‑+I2 ⑶①③④⑥
网址:http://m.1010jiajiao.com/timu_id_403908[举报]
如图a、b、c、d、e、f为元素周期表中前4周期相邻的一部分元素,下列有关叙述正确的是( )
| a | ||||
| b | c | |||
| d | e | |||
| f |
| A、b、c、e三种元素的原子半径大小关系:e>b>c |
| B、六种元素中,d元素的性质最稳定 |
| C、c的氢化物比f的氢化物的沸点低 |
| D、f元素的氢化物不是强电解质 |
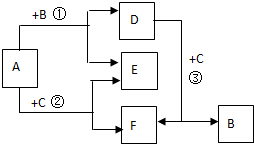 A~F都是中学化学常见物质,它们间的相互转化关系如图所示,其中A、D、F是化合物,E是非金属单质.
A~F都是中学化学常见物质,它们间的相互转化关系如图所示,其中A、D、F是化合物,E是非金属单质.(1)若B、C都是化合物,则E的分子式是
O2
O2
,反应①中每生成1molE转移电子的物质的量是2mol
2mol
,该反应的化学方程式:2Na2O2+2H20=4NaOH+O2↑
2Na2O2+2H20=4NaOH+O2↑
.(2)若B、C、E都是同主族非金属单质,则B、C、E三者的氧化性由强到弱的顺序是(用化学式表示)
Cl2>Br2>I2
Cl2>Br2>I2
;反应③的离子方程式是Cl2+2Br-=2Cl-+Br2
Cl2+2Br-=2Cl-+Br2
.(3)若B是日常生活中常见金属单质,C是非金属单质,且反应①②③均在高温下进行.反应①的化学方程式是
3Fe+4H2O(g)
Fe3O4+4H2
| ||
3Fe+4H2O(g)
Fe3O4+4H2
.
| ||
现有六种短周期元素A、B、C、D、E、F,其原子序数依次增大.A、E同主族,A元素原于半径是周期表中所有元素中最小的,B元素原子的最外层电子数是内层电子数的2倍.C元素最高价氧化物的水化物X能与其氢化物Y反应生成盐,F是地壳中含量最多的金属元素.A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物.?
(1)写出Y和D2在催化剂作用下反应的化学方程式
(2)将X和Y的水溶液充分混合后,常温下测得溶液的pH>7,则该溶液中离子浓度由大到小的顺序是
(3)甲是E元素最高价氧化物的水化物,乙是F元素的最高价氧化物,请写出乙与甲的水溶液发生反应的离子方程式
(4)用B的某种单质作电极,电解E元素的最高价氧化物对应水化物的水溶液时,阳极的电极反应式为
(5)燃料电池具有能量利用率高,可连续使用和污染小等优点.BA4和氧气可形成燃料电池,电解质溶液为KOH溶液,电极材料为石墨,该电池负极反应的电极反应式为
查看习题详情和答案>>
(1)写出Y和D2在催化剂作用下反应的化学方程式
4NH3+5O2
4NO+6H2O
| ||
| △ |
4NH3+5O2
4NO+6H2O
(用化学式表示,以下同).?
| ||
| △ |
(2)将X和Y的水溶液充分混合后,常温下测得溶液的pH>7,则该溶液中离子浓度由大到小的顺序是
c(NH4+)>c(NO3-)>c(OH-)>c(H+)或c(NH4+)>c(OH-)>c(NO3-)>c(H+)
c(NH4+)>c(NO3-)>c(OH-)>c(H+)或c(NH4+)>c(OH-)>c(NO3-)>c(H+)
.(3)甲是E元素最高价氧化物的水化物,乙是F元素的最高价氧化物,请写出乙与甲的水溶液发生反应的离子方程式
Al2O3+2OH-=2AlO2-+H2O
Al2O3+2OH-=2AlO2-+H2O
.?(4)用B的某种单质作电极,电解E元素的最高价氧化物对应水化物的水溶液时,阳极的电极反应式为
4OH-=2H2O+O2+4e-
4OH-=2H2O+O2+4e-
.(5)燃料电池具有能量利用率高,可连续使用和污染小等优点.BA4和氧气可形成燃料电池,电解质溶液为KOH溶液,电极材料为石墨,该电池负极反应的电极反应式为
CH4+10OH-=CO32-+6H2O+8e-
CH4+10OH-=CO32-+6H2O+8e-
,若该电池用于电解饱和食盐水的电源,当消耗1molBA4时,收集到Cl2的物质的量是4mol
4mol
.在相同温度下,体积均为1L的四个密闭容器中,保持温度和容积不变,以四种不同的投料方式进行反应.平衡时有关数据如下(已知2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ?mol-1).
|
查看习题详情和答案>>
A、B、C、D、E、F六种短周期主族元素,原子序数依次增大.其中B的单质在常温下为双原子分子,它与A的单质可形成分子X,X的水溶液呈碱性;D的简单阳离子与X具有相同电子数,且D是同周期中简单离子半径最小的元素;E元素的原子最外层比次外层少两个电子,C、F两种元素的原子最外层共有13个电子.则
(1)B的原子结构示意图
 ;
;
(2)B、C、E分别与A形成的化合物中最稳定的是
(3)C与D形成的化合物的化学式是
(4)F的单质在反应中常作
查看习题详情和答案>>
(1)B的原子结构示意图


(2)B、C、E分别与A形成的化合物中最稳定的是
H2O
H2O
(写化学式);(3)C与D形成的化合物的化学式是
Al2O3
Al2O3
,它的性质决定了它在物质的分类中应属于两性氧化物
两性氧化物
;请写出该化合物的水化物的电离方程式AlO2-+H++H2O Al(OH)3
Al(OH)3 Al3++3OH-
Al3++3OH-
 Al(OH)3
Al(OH)3 Al3++3OH-
Al3++3OH-AlO2-+H++H2O Al(OH)3
Al(OH)3 Al3++3OH-
Al3++3OH-
; Al(OH)3
Al(OH)3 Al3++3OH-
Al3++3OH-(4)F的单质在反应中常作
氧化
氧化
剂,该单质的水溶液与E的低价氧化物反应的离子方程式为SO2+Cl2+2H2O═4H++SO42-+2Cl-
SO2+Cl2+2H2O═4H++SO42-+2Cl-
.