题目内容
如图a、b、c、d、e、f为元素周期表中前4周期相邻的一部分元素,下列有关叙述正确的是( )
| a | ||||
| b | c | |||
| d | e | |||
| f |
| A、b、c、e三种元素的原子半径大小关系:e>b>c |
| B、六种元素中,d元素的性质最稳定 |
| C、c的氢化物比f的氢化物的沸点低 |
| D、f元素的氢化物不是强电解质 |
分析:图为元素周期表中前4周期相邻的一部分元素,由元素在周期表中的位置可知,a为He、b为O、c为F、d为Si、e为P、f为Br,
A.同周期随原子序数增大原子半径减小,同主族自上而下原子半径增大;
B.稀有气体的性质最稳定;
C.HF分子之间存在氢键,沸点高于同主族其它元素氢化物;
D.HBr溶于水完全电离,属于强电解质.
A.同周期随原子序数增大原子半径减小,同主族自上而下原子半径增大;
B.稀有气体的性质最稳定;
C.HF分子之间存在氢键,沸点高于同主族其它元素氢化物;
D.HBr溶于水完全电离,属于强电解质.
解答:解:图为元素周期表中前4周期相邻的一部分元素,由元素在周期表中的位置可知,a为He、b为O、c为F、d为Si、e为P、f为Br,
A.同周期随原子序数增大原子半径减小,同主族自上而下原子半径增大,故原子半径e>b>c,故A正确;
B.稀有气体He最外层为稳定结构,化学性质最稳定,故B错误;
C.HF分子之间存在氢键,HBr分子之间存在范德华力,氢键比范德华力更强,故HF沸点高于HBr,故C错误;
D.HBr溶于水完全电离,属于强电解质,故D错误,
故选A.
A.同周期随原子序数增大原子半径减小,同主族自上而下原子半径增大,故原子半径e>b>c,故A正确;
B.稀有气体He最外层为稳定结构,化学性质最稳定,故B错误;
C.HF分子之间存在氢键,HBr分子之间存在范德华力,氢键比范德华力更强,故HF沸点高于HBr,故C错误;
D.HBr溶于水完全电离,属于强电解质,故D错误,
故选A.
点评:本题考查元素周期表与元素周期律,注意理解元素周期律,注意氢键对物质性质的影响.

练习册系列答案
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案
相关题目
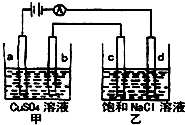 如图a、b、c、d均为石墨电极,通电进行电解.下列说法不正确的是( )
如图a、b、c、d均为石墨电极,通电进行电解.下列说法不正确的是( )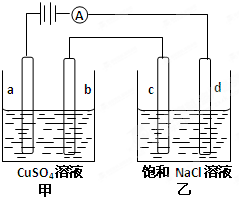 (2008?惠州模拟)如图a、b、C.d均为石墨电极,通电进行电解.
(2008?惠州模拟)如图a、b、C.d均为石墨电极,通电进行电解.
