摘要:A.SiO B.Si2O
网址:http://m.1010jiajiao.com/timu_id_403815[举报]
一、1.D 2.AB 3.C
4.解析:同温下NaHCO3比Na2CO3的溶解度要小。?
答案:CD?
5.C 6.D?
7.解析:SiO2+2NaOH===Na2SiO3+H2O CuSO4+BaCl2===BaSO4↓+CuCl2
Ca3(PO4)2+4H3PO4===3Cu(H2PO4)2。
答案:B?
8.CD?
二、9.(1)38.5 (2)0.582?
10.(1)原子
(2)Si3N4 (3)3SiCl4+6H2+2N2 Si3N4+12HCl
Si3N4+12HCl
11.Na2O?CaO?6SiO2 K2O?3Al2O3?6SiO2?2H2O?
12.Fe:
13.(1)SiO2+CaCO3 CaSiO3+CO2↑,CaCO3
CaSiO3+CO2↑,CaCO3 CaO+CO2↑
CaO+CO2↑
(2)
(3)
(2013?盐城一模)多晶硅是太阳能光伏产业的重要原材料.
(1)由石英砂可制取粗硅,其相关反应的热化学方程式如下:
SiO2(s)+C(s)═SiO(g)+CO(g),△H=akJ?mol-1
2SiO(g)═Si(s)+SiO2(s),△H=bkJ?mol-1
①反应SiO2(s)+2C(s)═Si(s)+2CO(g)的△H=
②SiO是反应过程中的中间产物,隔绝空气时,SiO与NaOH溶液反应(产物之一是硅酸钠)的化学方程式为
(2)粗硅提纯常见方法之一是先用粗硅与HCl反应,制得SiHCl3,经提纯后再用H2还原:SiHCl3(g)+H2(g)?Si(s)+3HCl(g).不同温度及不同
时,反应物X的平衡转化率关系如图1.
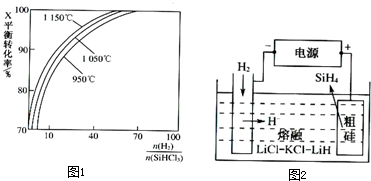
①X是
②上述反应的平衡常数:K(1150℃)
(3)SiH4(硅烷)法生产高纯多晶硅是非常优异的方法.
①用粗硅做原料,熔盐电解法制取硅烷原理如图2所示,电解时阳极的电极反应式为
②硅基太阳能电池需用N、Si两种元素组成的化合物Y做钝化材料,它可由SiH4与NH3混合气体进行气相沉积得到.已知Y中Si的质量分数为60%,Y的化学式为
查看习题详情和答案>>
(1)由石英砂可制取粗硅,其相关反应的热化学方程式如下:
SiO2(s)+C(s)═SiO(g)+CO(g),△H=akJ?mol-1
2SiO(g)═Si(s)+SiO2(s),△H=bkJ?mol-1
①反应SiO2(s)+2C(s)═Si(s)+2CO(g)的△H=
2a+b
2a+b
kJ?mol-1(用含a、b的代数式表示);②SiO是反应过程中的中间产物,隔绝空气时,SiO与NaOH溶液反应(产物之一是硅酸钠)的化学方程式为
SiO+2NaOH═Na2SiO3+H2
SiO+2NaOH═Na2SiO3+H2
.(2)粗硅提纯常见方法之一是先用粗硅与HCl反应,制得SiHCl3,经提纯后再用H2还原:SiHCl3(g)+H2(g)?Si(s)+3HCl(g).不同温度及不同
| n(H2) | n(SiHCl3) |

①X是
SiHCl3
SiHCl3
(填化学式);②上述反应的平衡常数:K(1150℃)
>
>
K(950℃)(填“>”、“<”或“=”).(3)SiH4(硅烷)法生产高纯多晶硅是非常优异的方法.
①用粗硅做原料,熔盐电解法制取硅烷原理如图2所示,电解时阳极的电极反应式为
Si+4H+-4e-═SiH4↑
Si+4H+-4e-═SiH4↑
.②硅基太阳能电池需用N、Si两种元素组成的化合物Y做钝化材料,它可由SiH4与NH3混合气体进行气相沉积得到.已知Y中Si的质量分数为60%,Y的化学式为
Si3N4
Si3N4
.C和Si元素在化学中占有极其重要的地位.
(1)写出Si的基态原子核外电子排布式
(2)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为
(3)氧化物MO的电子总数与SiC的相等,则M为
(4)C、Si为同一主族的元素,CO2和SiO2化学式相似,但结构和性质有很大不同.CO2中C与O原子间形成σ键和π键,SiO2中Si与O原子间不形成上述π健.从原子半径大小的角度分析,为何C、O原子间能形成,而Si、O原子间不能形成上述π健
(5)有A、B、C三种物质,每个分子中都各有14个电子,其中A的分子属于非极性分子,且只有非极性键;B的分子也属于非极性分子,但既有非极性键,又有极性键;C的分子属于极性分子.则可推出:A的电子式是
 ,B的结构式是
,B的结构式是
(6)已知Si-Si键能为176kJ/mol,Si-O键能为460kJ/mol,O=O键能为497.3kJ/mol.则可计算出1mol硅与足量氧气反应时将放出
查看习题详情和答案>>
(1)写出Si的基态原子核外电子排布式
1s22s22p63s23p2
1s22s22p63s23p2
.从电负性角度分析,C、Si和O元素的非金属活泼性由强至弱的顺序为O>C>Si
O>C>Si
.(2)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为
sp3
sp3
,微粒间存在的作用力是共价键
共价键
.(3)氧化物MO的电子总数与SiC的相等,则M为
Mg
Mg
(填元素符号),MO是优良的耐高温材料,其晶体结构与NaCl晶体相似,MO的熔点比CaO的高,其原因是Ca2+的离子半径大于Mg2+,MgO的晶格能大
Ca2+的离子半径大于Mg2+,MgO的晶格能大
.(4)C、Si为同一主族的元素,CO2和SiO2化学式相似,但结构和性质有很大不同.CO2中C与O原子间形成σ键和π键,SiO2中Si与O原子间不形成上述π健.从原子半径大小的角度分析,为何C、O原子间能形成,而Si、O原子间不能形成上述π健
Si、O原子间距离较大,p-p轨道肩并肩重叠程度较小,不能形成上述稳定的π键
Si、O原子间距离较大,p-p轨道肩并肩重叠程度较小,不能形成上述稳定的π键
.(5)有A、B、C三种物质,每个分子中都各有14个电子,其中A的分子属于非极性分子,且只有非极性键;B的分子也属于非极性分子,但既有非极性键,又有极性键;C的分子属于极性分子.则可推出:A的电子式是


H-C≡C-H
H-C≡C-H
.(6)已知Si-Si键能为176kJ/mol,Si-O键能为460kJ/mol,O=O键能为497.3kJ/mol.则可计算出1mol硅与足量氧气反应时将放出
=-990.7
=-990.7
kJ的热量.常温下,某未知溶液中
=1×1012,且含有大量Al3+和NO
,检验此溶液中是否大量存在以下6种离子:①SiO
、②NH
、③Fe2+、④Na+、⑤HCO
、⑥Cl-,其中不必检 验就能加以否定的离子是( )
| c(H+) |
| c(OH-) |
- 3 |
2- 3 |
+ 4 |
- 3 |
查看习题详情和答案>>
现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有 五种阳离子Na+、Al3+、Mg2+、Ba2+、Fe3+和五种阴离子Cl-、OH-、NO
、CO
、X中 的一种.
(1)某同学通过比较分析,认为无需检验就可判断其中必有的两种物质是 、 (填化学式).
(2)为了确定X,现将(1)中的两种物质记为A和B.当含X离子的C与A的溶液混 合时,产生红褐色沉淀和无色无味气体;当C与B的溶液混合时产生两种沉淀,向该沉淀中滴入足量的稀HNO3,沉淀部分溶解,最后留有白色沉淀.则:
①X为 (填序号).
A.SiO
B.CH3COO-C.SO
②A的水溶液中所有离子的浓度由大到小的顺序为 .
③化合物B的电子式 .
④将0.02mol的B与0.01mol的C同时溶解在足量的蒸馏水中,充分反应后,最终 所得沉淀的质量为 g(精确到0.1g).
⑤利用上述已经确定的一种物质,可以检验出D、E中的阳离子.请简述实验操作步 骤、现象及结论 .
(3)将Cu片投入到装有D溶液的试管中,Cu片不溶解;再滴加稀H2SO4,Cu片逐渐 溶解,试管口附近有红棕色气体出现,有关反应的离子方程式为 .
查看习题详情和答案>>
- 3 |
2- 3 |
(1)某同学通过比较分析,认为无需检验就可判断其中必有的两种物质是
(2)为了确定X,现将(1)中的两种物质记为A和B.当含X离子的C与A的溶液混 合时,产生红褐色沉淀和无色无味气体;当C与B的溶液混合时产生两种沉淀,向该沉淀中滴入足量的稀HNO3,沉淀部分溶解,最后留有白色沉淀.则:
①X为
A.SiO
2- 3 |
2- 4 |
②A的水溶液中所有离子的浓度由大到小的顺序为
③化合物B的电子式
④将0.02mol的B与0.01mol的C同时溶解在足量的蒸馏水中,充分反应后,最终 所得沉淀的质量为
⑤利用上述已经确定的一种物质,可以检验出D、E中的阳离子.请简述实验操作步 骤、现象及结论
(3)将Cu片投入到装有D溶液的试管中,Cu片不溶解;再滴加稀H2SO4,Cu片逐渐 溶解,试管口附近有红棕色气体出现,有关反应的离子方程式为
(2009?合肥三模)某些元素的性质或原子结构信息如下表所示:
(1)写出A单质与浓HNO3加热反应的化学方程式:
(2)写出B元素在周期表中的位置
(3)写出A与D的氧化物在高温下反应的化学方程式
(4)写出B、D形成的化合物与NaOH溶液反应的离子方程式:
(5)比较A、B、D三元素原子的第一电离能的大小
查看习题详情和答案>>
| A(短周期) | B(短周期) | C | D(短周期) |
| 原子最外层上p电子数等于次外层电子数 | 原子最外层有两个未成对电子,其单质为人类生存必须物质 | 单质为生活中常见的金属材料,有紫红色金属光泽 | 单质是常见的半导体材料,广泛应用于IT行业 |
C+4HNO3(浓)
CO2↑+4NO2↑+2H2O
| ||
C+4HNO3(浓)
CO2↑+4NO2↑+2H2O
.
| ||
(2)写出B元素在周期表中的位置
第二周期ⅥA族
第二周期ⅥA族
,写出C元素基态原子的电子排布式1s22s22p63s23p63d104s1
1s22s22p63s23p63d104s1
.(3)写出A与D的氧化物在高温下反应的化学方程式
2C+SiO2
2CO+Si
| ||
2C+SiO2
2CO+Si
.
| ||
(4)写出B、D形成的化合物与NaOH溶液反应的离子方程式:
SiO2+2OH-═SiO32-+H2O
SiO2+2OH-═SiO32-+H2O
.(5)比较A、B、D三元素原子的第一电离能的大小
O>C>Si
O>C>Si
(由大到小用元素符号表示)