摘要:4..如图所示:淀粉水解可产生某有机化合物A.A在不同的氧化剂作用下.可以生成B(C6H12O7)或C(C6H10O8).B和C都不能发生银镜反应.A.B.C都可以被强还原剂还原成为D(C6H14O6).B脱水可得到五元环的酯类化合物E或六元环的酯类化合物F.已知.相关物质被氧化的难易次序是:
网址:http://m.1010jiajiao.com/timu_id_400218[举报]
(2011?双流县模拟)I.硫酸铁糖衣药片是一种治疗缺铁性贫血的药剂.某化学课外活动小组测定其中铁元素含量的实验步骤如下:

(1)刮除药片糖衣称得样品ag,将其研碎后迅速溶解,配制溶液.操作如图所示,操作是否正确,
(2)洗涤的目的是除去附着在沉淀上的
(3)将沉淀物灼烧,冷却至室温,称得其质量为b1g,再次灼烧并冷却至室温称得其质量为b2 g,若b1-b2=0.3,则接下来的操作
(4)有同学认为:上述流程中若不加入氯水,其它步骤不变,仍可达到目的.他的理由是
(用化学方程式表示)
II.某化学兴趣小组在做实验时,将AgNO3溶液和KI溶液混合,发现有黄色沉淀生成,振荡后迅速消失.大家经查阅资料后发现,可能的原因是发生了下列反应:AgI+I- [AgI2]-
[AgI2]-
(1)甲同学设计了两个简单的实验方案来进行验证,请你协助他完成实验.
实验l:向浓Ⅺ溶液中滴加AgNO3溶液,观察到无沉淀生成.
实验2:向AgNO3溶液中滴加Ⅺ溶液,有黄色沉淀生成;再
(2)乙同学在实验所得的溶液中滴加硝酸溶液,结果又出现了沉淀.请解释出现沉淀的原因
(3)丙同学在实验所得的溶液中,滴加氯水也可以看到沉淀,但由于溶液为黄色,分不清沉淀的颜色.大家通过查阅数据,分析认为产生的沉淀不可能是AgCl,所查阅的数据是
同学们通过查阅资料知道,AgCl沉淀能溶于浓氨水.请写出这一反应的离子方程式
查看习题详情和答案>>

(1)刮除药片糖衣称得样品ag,将其研碎后迅速溶解,配制溶液.操作如图所示,操作是否正确,
不正确
不正确
,如不正确,说明原因(正确可不填写)
(2)洗涤的目的是除去附着在沉淀上的
NH4+、Cl-、SO42-、OH-、
NH4+、Cl-、SO42-、OH-、
.(写离子符号)(3)将沉淀物灼烧,冷却至室温,称得其质量为b1g,再次灼烧并冷却至室温称得其质量为b2 g,若b1-b2=0.3,则接下来的操作
再次加热,并置于干燥器中冷却,称量,直至两次质量差不超过0.1克为止
再次加热,并置于干燥器中冷却,称量,直至两次质量差不超过0.1克为止
,后通过计算可得出结果.(4)有同学认为:上述流程中若不加入氯水,其它步骤不变,仍可达到目的.他的理由是
4Fe(OH)2+O2+2H2O=4Fe(OH)3
4Fe(OH)2+O2+2H2O=4Fe(OH)3
(用化学方程式表示)
II.某化学兴趣小组在做实验时,将AgNO3溶液和KI溶液混合,发现有黄色沉淀生成,振荡后迅速消失.大家经查阅资料后发现,可能的原因是发生了下列反应:AgI+I-
 [AgI2]-
[AgI2]-(1)甲同学设计了两个简单的实验方案来进行验证,请你协助他完成实验.
实验l:向浓Ⅺ溶液中滴加AgNO3溶液,观察到无沉淀生成.
实验2:向AgNO3溶液中滴加Ⅺ溶液,有黄色沉淀生成;再
继续滴加KI溶液,黄色沉淀溶解
继续滴加KI溶液,黄色沉淀溶解
.(2)乙同学在实验所得的溶液中滴加硝酸溶液,结果又出现了沉淀.请解释出现沉淀的原因
加入硝酸溶液后,硝酸将碘离子氧化,使碘离子浓度减小,平衡AgI+I-?[AgI2]-逆向移动
加入硝酸溶液后,硝酸将碘离子氧化,使碘离子浓度减小,平衡AgI+I-?[AgI2]-逆向移动
.(3)丙同学在实验所得的溶液中,滴加氯水也可以看到沉淀,但由于溶液为黄色,分不清沉淀的颜色.大家通过查阅数据,分析认为产生的沉淀不可能是AgCl,所查阅的数据是
AgI、AgCl的溶解度
AgI、AgCl的溶解度
.同学们通过查阅资料知道,AgCl沉淀能溶于浓氨水.请写出这一反应的离子方程式
AgCl+2NH3?H2O=[Ag(NH3)2]++Cl-+2H2O;
AgCl+2NH3?H2O=[Ag(NH3)2]++Cl-+2H2O;
.某课外活动小组欲制取次氯酸钠和氯化钠的混合溶液,为提高次氯酸钠的含量,用如图所示装置.图中瓶乙盛饱和食盐水,瓶丙盛放浓硫酸,分液漏斗A中盛浓盐酸.(据资料显示:Cl2与NaOH在不同温度下,产物不同.在较高温度下易生成NaClO3)

试回答:
(1)烧瓶B中盛
(2)有同学认为可以省去某些装置,你认为怎样:
①能否省去乙装置
②装置丙是否有必要
(3)有同学认为还必须加入某些装置,你认为怎样?
(4)丁装置中冰水的作用是
查看习题详情和答案>>

试回答:
(1)烧瓶B中盛
MnO2
MnO2
,试管C中盛NaOH溶液
NaOH溶液
.(2)有同学认为可以省去某些装置,你认为怎样:
①能否省去乙装置
不能
不能
(填“能”或“不能”),理由是HCl气体进入C中,消耗NaOH,降低NaClO的含量
HCl气体进入C中,消耗NaOH,降低NaClO的含量
.②装置丙是否有必要
没有
没有
(填“有”或“没有”),理由是少量水蒸气进入C中,不影响反应
少量水蒸气进入C中,不影响反应
.(3)有同学认为还必须加入某些装置,你认为怎样?
需要
需要
(填“需要”或“不需要”),如果你认为需要,请指出该装置的作用应加上尾气处理装置,防止Cl2污染空气
应加上尾气处理装置,防止Cl2污染空气
.(4)丁装置中冰水的作用是
防止Cl2与NaOH溶液在温度较高时,发生其他反应
防止Cl2与NaOH溶液在温度较高时,发生其他反应
.(2010?南通模拟)工业碳酸钠(纯度约为98%)中常含有Ca2+、Mg2+、Fe3+、Clˉ和SO42ˉ等杂质,为了提纯工业碳酸钠,并获得试剂级碳酸钠的工艺流程图如下: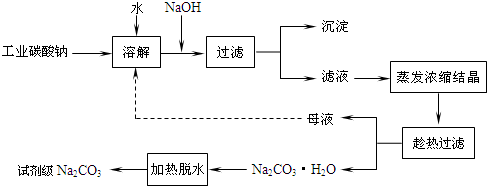
已知:碳酸钠的饱和溶液在不同温度下析出的溶质如图所示: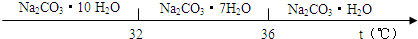
(1)加入NaOH溶液时发生的离子反应方程式为
(2)热的Na2CO3溶液有较强的去油污能力,其原因是(用离子方程式及必要的文字加以解释)
(3)“趁热过滤”时的温度应控制在
(4)已知:Na2CO3?10H2O(s)=Na2CO3(s)+10H2O(g)△H=+532.36kJ?mol-1
Na2CO3?10H2O(s)=Na2CO3?H2O(s)+9H2O(g)△H=+473.63kJ?mol-1
写出Na2CO3?H2O脱水反应的热化学方程式
(5)有人从“绿色化学”角度设想将“母液”沿流程图中虚线所示进行循环使用.请你分析实际生产中是否可行
查看习题详情和答案>>

已知:碳酸钠的饱和溶液在不同温度下析出的溶质如图所示:
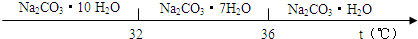
(1)加入NaOH溶液时发生的离子反应方程式为
Fe3++3OH-=Fe(OH)3↓
Fe3++3OH-=Fe(OH)3↓
、MgCO3+2OH-=Mg(OH )2↓+CO32-
MgCO3+2OH-=Mg(OH )2↓+CO32-
.(2)热的Na2CO3溶液有较强的去油污能力,其原因是(用离子方程式及必要的文字加以解释)
Na2CO3在溶液中存在水解平衡CO32-+H2O?HCO3-+OH-,溶液呈碱性,当温度升高时水解平衡正向移动,使溶液碱性增强,故去油污能力增强
Na2CO3在溶液中存在水解平衡CO32-+H2O?HCO3-+OH-,溶液呈碱性,当温度升高时水解平衡正向移动,使溶液碱性增强,故去油污能力增强
.(3)“趁热过滤”时的温度应控制在
高于36℃
高于36℃
.(4)已知:Na2CO3?10H2O(s)=Na2CO3(s)+10H2O(g)△H=+532.36kJ?mol-1
Na2CO3?10H2O(s)=Na2CO3?H2O(s)+9H2O(g)△H=+473.63kJ?mol-1
写出Na2CO3?H2O脱水反应的热化学方程式
Na2CO3?H2O(S)═Na2CO3(s)+H2O(g)△H=+58.73kJ/mol
Na2CO3?H2O(S)═Na2CO3(s)+H2O(g)△H=+58.73kJ/mol
.(5)有人从“绿色化学”角度设想将“母液”沿流程图中虚线所示进行循环使用.请你分析实际生产中是否可行
不可行
不可行
,其理由是若“母液”循环使用,则溶液c(Cl-)和c(SO42-)增大,最后所得产物Na2CO3中混有杂质
若“母液”循环使用,则溶液c(Cl-)和c(SO42-)增大,最后所得产物Na2CO3中混有杂质
.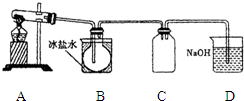 室验室制N2O4需用NO2时,可用无水硝酸盐加热分解获得.已知硝酸盐分解时NO3-完全转化为NO2,现有硝酸盐:a Cu (NO3)2、b Mn (NO3)2、c Hg (NO3)2,若利用加热分解方法制NO2,已知它们分解后的固体生成物为CuO、MnO2、Hg等,并按以下装置(如图所示)制取N2O4;
室验室制N2O4需用NO2时,可用无水硝酸盐加热分解获得.已知硝酸盐分解时NO3-完全转化为NO2,现有硝酸盐:a Cu (NO3)2、b Mn (NO3)2、c Hg (NO3)2,若利用加热分解方法制NO2,已知它们分解后的固体生成物为CuO、MnO2、Hg等,并按以下装置(如图所示)制取N2O4;(1)三种硝酸盐分解时氧化产物与还原产物物质的量之比等于1:4的是
Cu (NO3)2
Cu (NO3)2
.(2)在A中试管内应装入的上述硝酸盐粉末(使产生的NO2最纯净)中应选用的是(写化学式)
Mn (NO3)2
Mn (NO3)2
,其反应的化学方程式为Mn(NO3)2
MnO2+2NO2↑
| ||
Mn(NO3)2
MnO2+2NO2↑
,不应该用的硝酸盐是
| ||
Hg(NO3)2和Cu(NO3)2
Hg(NO3)2和Cu(NO3)2
,理由是因为Hg(NO3)2分解会产生Hg蒸气和O2,Cu(NO3)2分解会产生O2而使NO2不纯
因为Hg(NO3)2分解会产生Hg蒸气和O2,Cu(NO3)2分解会产生O2而使NO2不纯
.(3)B中的烧瓶得到的气体应为
棕黄
棕黄
色,理由是NO2存在平衡:2NO2?N2O4
NO2存在平衡:2NO2?N2O4
.(4)C装置的作用是
起安全瓶作用,防止D中的碱液倒吸至B中
起安全瓶作用,防止D中的碱液倒吸至B中
.(5)D装置的作用是
吸收尾气
吸收尾气
,其中反应的离子方程式为2NO2+2OH-=NO3-+NO2-+H2O
2NO2+2OH-=NO3-+NO2-+H2O
. (2011?安徽)科学家最近研制出可望成为高效火箭推进剂的N(NO2)3(如图所示).已知该分子中N-N-N键角都是108.1°,下列有关N(NO2)3的说法正确的是( )
(2011?安徽)科学家最近研制出可望成为高效火箭推进剂的N(NO2)3(如图所示).已知该分子中N-N-N键角都是108.1°,下列有关N(NO2)3的说法正确的是( )