题目内容
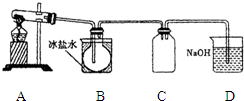 室验室制N2O4需用NO2时,可用无水硝酸盐加热分解获得.已知硝酸盐分解时NO3-完全转化为NO2,现有硝酸盐:a Cu (NO3)2、b Mn (NO3)2、c Hg (NO3)2,若利用加热分解方法制NO2,已知它们分解后的固体生成物为CuO、MnO2、Hg等,并按以下装置(如图所示)制取N2O4;
室验室制N2O4需用NO2时,可用无水硝酸盐加热分解获得.已知硝酸盐分解时NO3-完全转化为NO2,现有硝酸盐:a Cu (NO3)2、b Mn (NO3)2、c Hg (NO3)2,若利用加热分解方法制NO2,已知它们分解后的固体生成物为CuO、MnO2、Hg等,并按以下装置(如图所示)制取N2O4;(1)三种硝酸盐分解时氧化产物与还原产物物质的量之比等于1:4的是
Cu (NO3)2
Cu (NO3)2
.(2)在A中试管内应装入的上述硝酸盐粉末(使产生的NO2最纯净)中应选用的是(写化学式)
Mn (NO3)2
Mn (NO3)2
,其反应的化学方程式为Mn(NO3)2
MnO2+2NO2↑
| ||
Mn(NO3)2
MnO2+2NO2↑
,不应该用的硝酸盐是
| ||
Hg(NO3)2和Cu(NO3)2
Hg(NO3)2和Cu(NO3)2
,理由是因为Hg(NO3)2分解会产生Hg蒸气和O2,Cu(NO3)2分解会产生O2而使NO2不纯
因为Hg(NO3)2分解会产生Hg蒸气和O2,Cu(NO3)2分解会产生O2而使NO2不纯
.(3)B中的烧瓶得到的气体应为
棕黄
棕黄
色,理由是NO2存在平衡:2NO2?N2O4
NO2存在平衡:2NO2?N2O4
.(4)C装置的作用是
起安全瓶作用,防止D中的碱液倒吸至B中
起安全瓶作用,防止D中的碱液倒吸至B中
.(5)D装置的作用是
吸收尾气
吸收尾气
,其中反应的离子方程式为2NO2+2OH-=NO3-+NO2-+H2O
2NO2+2OH-=NO3-+NO2-+H2O
.分析:(1)根据三种硝酸盐的分解方程式来判断;
(2)根据分解产物的多少以及产物的性质;
(3)根据分解产生气体的颜色及存在可逆反应;
(4)根据C装置是防止D中的碱液倒吸至B中;
(5)根据D装置的作用是吸收多余的NO2,
(2)根据分解产物的多少以及产物的性质;
(3)根据分解产生气体的颜色及存在可逆反应;
(4)根据C装置是防止D中的碱液倒吸至B中;
(5)根据D装置的作用是吸收多余的NO2,
解答:解:(1)三种硝酸盐的分解方程式为:2Cu(NO3)2
2CuO+4NO2↑+O2↑,Mn(NO3)2
MnO2+2NO2↑,Hg(NO3)2
Hg+2NO2↑+O2↑,分解时氧化产物与还原产物物质的量之比等于1:4的是Cu(NO3)2,故答案为:Cu (NO3)2;
(2)因Mn(NO3)2分解产生的气体只有NO2,Cu(NO3)2分解产生的气体有NO2和O2↑,Hg(NO3)2 分解产生的气体有NO2和O2,又因Hg挥发产生了Hg蒸气,
故答案为:Mn (NO3)2;Mn(NO3)2
MnO2+2NO2↑;Hg(NO3)2和Cu(NO3);因为Hg(NO3)2分解会产生Hg蒸气和O2,Cu(NO3)2分解会产生O2而使NO2不纯;
(3)因Mn(NO3)2分解产生的气体只有NO2为红棕色,但NO2存在平衡:2NO2?N2O4,降低温度,平衡正向移动,颜色变浅,为棕黄色,故答案为:棕黄;NO2存在平衡:2NO2?N2O4;
(4)因C装置是防止D中的碱液倒吸至B中,起安全瓶作用,故答案为:起安全瓶作用,防止D中的碱液倒吸至B中;
(5)D装置的作用是吸收多余的NO2,化学方程式为2NO2+2NaOH-=NaNO3+NaNO2+H2O,
故答案为:吸收尾气;2NO2+2OH-=NO3-+NO2-+H2O.
| ||
| ||
| ||
(2)因Mn(NO3)2分解产生的气体只有NO2,Cu(NO3)2分解产生的气体有NO2和O2↑,Hg(NO3)2 分解产生的气体有NO2和O2,又因Hg挥发产生了Hg蒸气,
故答案为:Mn (NO3)2;Mn(NO3)2
| ||
(3)因Mn(NO3)2分解产生的气体只有NO2为红棕色,但NO2存在平衡:2NO2?N2O4,降低温度,平衡正向移动,颜色变浅,为棕黄色,故答案为:棕黄;NO2存在平衡:2NO2?N2O4;
(4)因C装置是防止D中的碱液倒吸至B中,起安全瓶作用,故答案为:起安全瓶作用,防止D中的碱液倒吸至B中;
(5)D装置的作用是吸收多余的NO2,化学方程式为2NO2+2NaOH-=NaNO3+NaNO2+H2O,
故答案为:吸收尾气;2NO2+2OH-=NO3-+NO2-+H2O.
点评:本题结合实验考查了NO2的制备与性质,培养了学生分析问题,解决问题的能力.

练习册系列答案
相关题目
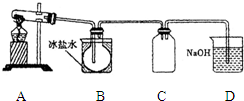 室验室制N2O4需用NO2时,可用无水硝酸盐加热分解获得.已知硝酸盐分解时NO3-完全转化为NO2,现有硝酸盐:a Cu (NO3)2、b Mn (NO3)2、c Hg (NO3)2,若利用加热分解方法制NO2,已知它们分解后的固体生成物为CuO、MnO2、Hg等,并按以下装置(如图所示)制取N2O4;
室验室制N2O4需用NO2时,可用无水硝酸盐加热分解获得.已知硝酸盐分解时NO3-完全转化为NO2,现有硝酸盐:a Cu (NO3)2、b Mn (NO3)2、c Hg (NO3)2,若利用加热分解方法制NO2,已知它们分解后的固体生成物为CuO、MnO2、Hg等,并按以下装置(如图所示)制取N2O4;