摘要:[巩固练习]课堂反馈
网址:http://m.1010jiajiao.com/timu_id_399122[举报]
有一种褐铁矿主要成分是Fe2O3,所含杂质不溶于水和酸.某研究性学习小组的同学们利用一小块样品,进行了以下实验.
(1)检验矿物样品中是否有Fe3+
【实验用品】锤子、研钵、烧杯、玻璃棒、漏斗、铁架台、滤纸、试管、胶头滴管
【实验步骤】①取样:将样品用锤子敲碎,再在研钵中研细备用.
②溶解:将样品粉末倒入烧杯,加入 ,用玻璃棒充分搅拌.
③过滤.
④检验:取少许滤液于试管中,滴加 .实验现象: .
【实验结论】矿物样品中含有Fe3+.
(2)制备氢氧化亚铁
①为了得到亚铁盐的溶液,同学们在剩余的溶液中加入过量的某种固体试剂,该试剂是(填化学式) ,反应的离子方程式是 .
②同学们在新制得的亚铁盐溶液中加入不含O2的蒸溜水配制的NaOH溶液,制出的氢氧化亚铁.)其操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液.要这样操作的理由是 .
写出氢氧化亚铁和氧气反应的化学方程式: .
查看习题详情和答案>>
(1)检验矿物样品中是否有Fe3+
【实验用品】锤子、研钵、烧杯、玻璃棒、漏斗、铁架台、滤纸、试管、胶头滴管
【实验步骤】①取样:将样品用锤子敲碎,再在研钵中研细备用.
②溶解:将样品粉末倒入烧杯,加入
③过滤.
④检验:取少许滤液于试管中,滴加
【实验结论】矿物样品中含有Fe3+.
(2)制备氢氧化亚铁
①为了得到亚铁盐的溶液,同学们在剩余的溶液中加入过量的某种固体试剂,该试剂是(填化学式)
②同学们在新制得的亚铁盐溶液中加入不含O2的蒸溜水配制的NaOH溶液,制出的氢氧化亚铁.)其操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液.要这样操作的理由是
写出氢氧化亚铁和氧气反应的化学方程式:
某同学将一定浓度的Na2CO3溶液加入CuSO4溶液中,发现生成了沉淀.其对沉淀的成分进行如下探究:
【提出假设】
假设1:沉淀是CuCO3;
假设2: ;
假设3:沉淀是CuCO3和Cu(OH)2的混合物.
【验证假设】
(1)如果假设1成立,则反应的离子方程式为 .
(2)用离子方程式表示假设3中有Cu(OH)2生成的理论依据: .
(3)为证明以上哪种假设成立,该同学用如图装置测定沉淀样品中CuCO3的质量分数:
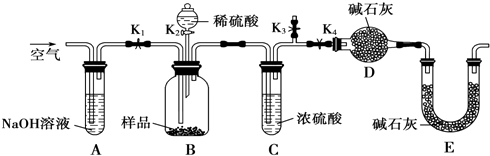
①实验时的步骤依次为:
a.打开K1、K3,关闭K2、K4,通入过量空气;
b.关闭K1、K3,打开K2、K4,充分反应;
c.打开K1、K4,关闭K2、K3,通入过量空气,
若未进行步骤a,将使测定结果 .实验结束时通入过量空气的目的是 .
②若沉淀样品的质量为10.0g,装置D的质量增加了2.2g,则沉淀中CuCO3的质量分数为 .
③由以上实验可知,假设 成立.
【总结反思】除了以上方案,还可以设计其它方案通过测量 来测定沉淀中CuCO3的质量分数.
查看习题详情和答案>>
【提出假设】
假设1:沉淀是CuCO3;
假设2:
假设3:沉淀是CuCO3和Cu(OH)2的混合物.
【验证假设】
(1)如果假设1成立,则反应的离子方程式为
(2)用离子方程式表示假设3中有Cu(OH)2生成的理论依据:
(3)为证明以上哪种假设成立,该同学用如图装置测定沉淀样品中CuCO3的质量分数:

①实验时的步骤依次为:
a.打开K1、K3,关闭K2、K4,通入过量空气;
b.关闭K1、K3,打开K2、K4,充分反应;
c.打开K1、K4,关闭K2、K3,通入过量空气,
若未进行步骤a,将使测定结果
②若沉淀样品的质量为10.0g,装置D的质量增加了2.2g,则沉淀中CuCO3的质量分数为
③由以上实验可知,假设
【总结反思】除了以上方案,还可以设计其它方案通过测量
已知某混合金属粉末,除铝处还含有铁、铜中的一种或两种,所含金属的量都在5%以上.请设计合理实验探究该混合物金属粉末中铁、铜元素的存在.
仅限选择的仪器和试剂:烧杯、试管、玻璃棒、量筒、容量瓶、滴管、药匙;1mol/L硫酸、2mol/L硝酸、2mol/LNaOH溶液、20%KSCN溶液.
完成以下实验探究过程:
【提出假设】
假设1 该混合金属粉末中除铝外还含有 元素;
假设2 该混合金属粉末中除铝外还含有 元素;
假设3 该混合金属粉末中除铝外还含有Fe、Cu元素;
【设计实验方案】
基于假设3,设计出实验方案(不要在答题卡上作答).
【实验过程】
根据上述实验方案,完成实验的相关操作、预期现象和结论.提示:在答题卡上按以下方式作答,注意前后内容对应.
【反思】
写出在实验①中发生反应的离子方程式: .
查看习题详情和答案>>
仅限选择的仪器和试剂:烧杯、试管、玻璃棒、量筒、容量瓶、滴管、药匙;1mol/L硫酸、2mol/L硝酸、2mol/LNaOH溶液、20%KSCN溶液.
完成以下实验探究过程:
【提出假设】
假设1 该混合金属粉末中除铝外还含有
假设2 该混合金属粉末中除铝外还含有
假设3 该混合金属粉末中除铝外还含有Fe、Cu元素;
【设计实验方案】
基于假设3,设计出实验方案(不要在答题卡上作答).
【实验过程】
根据上述实验方案,完成实验的相关操作、预期现象和结论.提示:在答题卡上按以下方式作答,注意前后内容对应.
| 编号 | 实验操作 | 实验现象 | 结论 |
| ① | 用药匙取少许样品,加入试管A中,再用滴管取过量 |
有固体剩余,并有气泡产生 | 合金中除铝外还含有Fe、Cu 元素 |
| ② | 往试管A的剩余固体中加过量 |
固体部分溶解,并有气体放出,溶液呈浅绿色 | |
| ③ | 往试管B中加入少量 |
||
| ④ | 往②剩余固体中加入稀硝酸;再滴加 |
固体溶解,有无色刺激性气体产生并很快变成红棕色,溶液显蓝色;再加某溶液后有蓝色沉淀产生 |
写出在实验①中发生反应的离子方程式:
(2012?虹口区二模)某实验兴趣小组为了测定镀锌铁皮中锌的质量分数ω(Zn),设计如下实验方案.
【方案甲】测定试样与6mol/L盐酸溶液反应前后固体的质量变化,流程如下:

(1)操作II中镀层反应完的标志是
(2)操作III中,检验铁片已洗净的方法是
(3)若要进一步计算锌镀层厚度,还需知道的物理量是:镀锌铁皮的表面积S、
【方案乙】测定试样与6mol/L的烧碱溶液反应生成的氢气体积,装置如图:

[已知:锌易溶于强碱溶液:Zn+2NaOH+2H2O→Na2Zn(OH)4+H2↑]
(4)配制250mL 6mol/L的NaOH溶液,需要量取48%的浓NaOH溶液(密度为1.506g/cm3)
(5)为精确测定H2体积,在反应结束并冷却后,用针筒在储液瓶左侧乳胶管处进行抽气,直至
(6)已知镀锌铁皮的质量为m g,加入烧碱溶液的体积为V1mL(所有体积数据均已折算至标准状况,下同),最终液体量瓶中水的体积为V2mL,针筒抽出气体的体积为V3mL.选择合理数据,计算ω(Zn)=
×100%
×100%.
查看习题详情和答案>>
【方案甲】测定试样与6mol/L盐酸溶液反应前后固体的质量变化,流程如下:

(1)操作II中镀层反应完的标志是
生成氢气的速率突然减慢
生成氢气的速率突然减慢
.操作IV的名称是烘干
烘干
.(2)操作III中,检验铁片已洗净的方法是
取最后一次洗涤液,加入硝酸银溶液,无白色沉淀产生,则铁片已洗净
取最后一次洗涤液,加入硝酸银溶液,无白色沉淀产生,则铁片已洗净
.(3)若要进一步计算锌镀层厚度,还需知道的物理量是:镀锌铁皮的表面积S、
金属锌的密度
金属锌的密度
.【方案乙】测定试样与6mol/L的烧碱溶液反应生成的氢气体积,装置如图:

[已知:锌易溶于强碱溶液:Zn+2NaOH+2H2O→Na2Zn(OH)4+H2↑]
(4)配制250mL 6mol/L的NaOH溶液,需要量取48%的浓NaOH溶液(密度为1.506g/cm3)
83
83
mL,用规格为100
100
mL量筒量取.(5)为精确测定H2体积,在反应结束并冷却后,用针筒在储液瓶左侧乳胶管处进行抽气,直至
储液瓶中导管内外液面相平
储液瓶中导管内外液面相平
为止.若省略此步骤,测得的体积数据将偏小
偏小
(填“偏大”、“偏小”或“不变”).(6)已知镀锌铁皮的质量为m g,加入烧碱溶液的体积为V1mL(所有体积数据均已折算至标准状况,下同),最终液体量瓶中水的体积为V2mL,针筒抽出气体的体积为V3mL.选择合理数据,计算ω(Zn)=
| 65×(V2+V3)×10-3 |
| 22.4×m |
| 65×(V2+V3)×10-3 |
| 22.4×m |
 绿矾是一种重要的化工原料.
绿矾是一种重要的化工原料.【问题1】绿矾晶体(FeSO4?7H2O)由于保存不妥或长久放置,容易被空气中的氧气氧化而变质.为探究绿矾样品的变质情况,化学兴趣小组的同学设计了下列实验方案.可供选择的试剂:KSCN溶液、酸性KMnO4溶液、氯水、NaOH溶液、BaCl2溶液请参与完成方案设计.
实验准备:取少量绿矾样品,用蒸馏水在烧杯中配成溶液.
(1)方案1:取少量溶液,加入几滴
(2)方案2:取少量溶液,加入几滴酸性KMnO4溶液,如果观察到的现象是
(3)使用FeSO4时,如要防止Fe3+的干扰,可以加入适量铁粉进行除杂,写出加入铁粉后发生反应的离子方程式
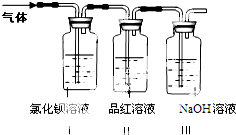
【问题2】灼烧绿矾的反应方程式:2(FeSO4?7H2O)
| ||
(1)装置Ⅰ中氯化钡溶液中可观察到现象
(2)装置Ⅱ中试剂为品红溶液,其作用是
(3)装置Ⅲ中试剂为NaOH溶液,其目的是