网址:http://m.1010jiajiao.com/timu_id_398873[举报]
元素 | H | Li | Be | B | C | N | O | F |
电负性 | 2.1 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
元素 | Na | Mg | Al | Si | P | S | Cl | K |
电负性 | 0.9 | 1.2 | 1.5 | 1.7 | 2.1 | 2.3 | 3.0 | 0.8 |
请仔细分析,完成下列有关问题:
(1)预测周期表中电负性最大的元素应为______;估计钙元素的电负性的取值范围:__________<X<__________。
(2)根据表中的所给数据分析,同主族内的不同元素X的值变化的规律是_______________________________________;简述元素电负性X的大小与元素金属性、非金属性之间的关系________________________________________。?
(3)经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中形成的化学键的类型为__________,其理由是__________。
查看习题详情和答案>>(10分)1932年美国化学家鲍林首先提出了电负性的概念。电负性(用X表示)也是元素的一种重要性质,下表给出的是原子序数小于20的16种元素的电负性数值: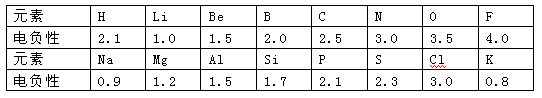
请仔细分析,回答下列有关问题:
①预测周期表中电负性最大的元素应为_____;估计钙元素的电负性的取值范围: < X < 。
②根据表中的所给数据分析,同主族内的不同元素X的值变化的规律是
; 简述元素电负性X的大小与元素金属性、非金属性之间的关系 。
③经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中形成的化学键的类型为 。
(10分)1932年美国化学家鲍林首先提出了电负性的概念。电负性(用X表示)也是元素的一种重要性质,下表给出的是原子序数小于20的16种元素的电负性数值:

请仔细分析,回答下列有关问题:
①预测周期表中电负性最大的元素应为_____;估计钙元素的电负性的取值范围: < X < 。
②根据表中的所给数据分析,同主族内的不同元素X的值变化的规律是
; 简述元素电负性X的大小与元素金属性、非金属性之间的关系 。
③经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中形成的化学键的类型为 。
查看习题详情和答案>>
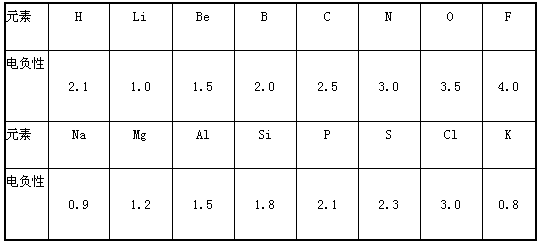
(1)预测周期表中电负性最大的元素应为________(填元素名称);估计钙元素的电负性的取值范围: ______<x<____。
(2)根据表中所给数据分析,同主族内不同元素x 的值的变化规律是____________________;简述元素电负性x的大小与元素金属性、非金属性之间的关系。
__________________________
(3)经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中形成的化学键的类型为
___________,其理由是__________________________。
| 元素 | H | Li | Be | B | C | N | O | F |
| 电负性 | 2.1 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.7 | 2.1 | 2.3 | 3.0 | 0.8 |
(2)简述元素电负性X的大小与元素金属性、非金属性之间的关系
。
(3)经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的键一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中形成的化学键的类型为 ;上表中最易形成离子键的两种元素的电负性之差为 。