题目内容
 (2009?南京二模)某同学对Cu与HNO3的反应进行如下探究.请回答有关问题.
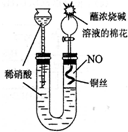
(2009?南京二模)某同学对Cu与HNO3的反应进行如下探究.请回答有关问题.(1)用如图所示装置制取NO,验证U型管中生成的气体是NO的实验方法是
打开分液漏斗的活塞,观察无色气体在分液漏斗变为红棕色,即证明管中生成的是NO
打开分液漏斗的活塞,观察无色气体在分液漏斗变为红棕色,即证明管中生成的是NO
.(2)将0.64g Cu全部溶于一定量的浓HNO3中,测得生成气体0.009mol(含NO、NO2和N2O4),共消耗HNO3 0.032mol.将生成的气体与空气混合,再通入NaOH溶液中,氮氧化物被完全吸收,产物只有NaNO3和H2O.
①计算空气中参加反应的O2在标准状况下的体积为
112
112
mL.②计算0.009mol 混合气体中N2O4的物质的量(写出计算过程)
设NO为xmol,NO2为ymol,N2O4为zmol,则:
x+y+z=0.009;
根据N元素守恒有,x+y+2z+0.01×2=0.032,
联立方程解得:z=0.003.
x+y+z=0.009;
根据N元素守恒有,x+y+2z+0.01×2=0.032,
联立方程解得:z=0.003.
设NO为xmol,NO2为ymol,N2O4为zmol,则:
x+y+z=0.009;
根据N元素守恒有,x+y+2z+0.01×2=0.032,
联立方程解得:z=0.003.
.x+y+z=0.009;
根据N元素守恒有,x+y+2z+0.01×2=0.032,
联立方程解得:z=0.003.
分析:(1)打开分液漏斗的活塞,观察无色气体在分液漏斗变为红棕色,即证明管中生成的是NO.
(2)①0.64g的Cu即0.01mol,全部反应,失去电子0.02mol,则N元素获得电子共0.02mol,生成了NO、NO2和N2O4,但是,将气体与O2通入NaOH,则这些气体又被O2氧化成NO3-,即O2共获得电子0.02mol,据此计算O2物质的量,根据V=nVm计算O2体积.
②设NO为xmol,NO2为ymol,N2O4为zmol,所以有x+y+z=0.009;根据N元素守恒有,x+y+2z+0.01×2=0.032,联立方程计算.
(2)①0.64g的Cu即0.01mol,全部反应,失去电子0.02mol,则N元素获得电子共0.02mol,生成了NO、NO2和N2O4,但是,将气体与O2通入NaOH,则这些气体又被O2氧化成NO3-,即O2共获得电子0.02mol,据此计算O2物质的量,根据V=nVm计算O2体积.
②设NO为xmol,NO2为ymol,N2O4为zmol,所以有x+y+z=0.009;根据N元素守恒有,x+y+2z+0.01×2=0.032,联立方程计算.
解答:解:(1)打开分液漏斗的活塞,观察无色气体在分液漏斗变为红棕色,即证明管中生成的是NO,
故答案为:打开分液漏斗的活塞,观察无色气体在分液漏斗变为红棕色,即证明管中生成的是NO;
(2)①0.64gCu的物质的量为
=0.01mol,全部反应失去电子为0.01mol×2=0.02mol,则N元素获得电子共0.02mol,生成了NO、NO2和N2O4,但是,将气体与O2通入NaOH,则这些气体又被O2氧化成NO3-,即O2共获得电子0.02mol,O2物质的量为
=0.005mol,标准状况下O2体积为0.005mol×22.4L/mol=0.112L=112mL,
故答案为:112;
②设NO为xmol,NO2为ymol,N2O4为zmol,则:
x+y+z=0.009;
根据N元素守恒有,x+y+2z+0.01×2=0.032,
联立方程解得:z=0.003.
故答案为:设NO为xmol,NO2为ymol,N2O4为zmol,则:
x+y+z=0.009;
根据N元素守恒有,x+y+2z+0.01×2=0.032,
联立方程解得:z=0.003.
故答案为:打开分液漏斗的活塞,观察无色气体在分液漏斗变为红棕色,即证明管中生成的是NO;
(2)①0.64gCu的物质的量为
| 0.64g |
| 64g/mol |
| 0.02mol |
| 4 |
故答案为:112;
②设NO为xmol,NO2为ymol,N2O4为zmol,则:
x+y+z=0.009;
根据N元素守恒有,x+y+2z+0.01×2=0.032,
联立方程解得:z=0.003.
故答案为:设NO为xmol,NO2为ymol,N2O4为zmol,则:
x+y+z=0.009;
根据N元素守恒有,x+y+2z+0.01×2=0.032,
联立方程解得:z=0.003.
点评:本题考查混合计算等,难度中等,(2)中①判断O2共获得电子等于铜失去的电子是关键.

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
 下列说法错误的是( )
下列说法错误的是( )