摘要:(已知1g2=0.3).则H2R在水溶液中的电离方程式为 (3)100℃时.将pH=9的NaOH溶液与pH=4的硫酸溶液混合.若所得溶液pH=7.则NaOH溶液与硫酸溶液的体积比为 . (4)100℃时.若10体积的某强酸溶液与1体积的某强碱溶液混合后溶液呈中性.则混合之前强酸溶液的pH与强碱溶液的pH之间应满足的关系是 .答案(1)10―14 10―12 温度升高.水的电离程度增大.溶液中的H+和OH―浓度增大.Kw增大
网址:http://m.1010jiajiao.com/timu_id_386624[举报]
水的电离平衡曲线如图所示:
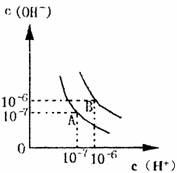
(1)若以A点表示25℃水在电离平衡时的离子浓度,当温度上升到100℃时,水的电离平衡状态到B点,则此时水的离子积从 增加到 ,造成水的离子积增大的原因是 ___________________
。
(2)已知:25℃时,0.1mol/L的H2R溶液的0.7<pH<1(已知1g2=0.3),则H2R在水溶液中的电离方程式为
(3)100℃时,将pH=9的NaOH溶液与pH=4的硫酸溶液混合,若所得溶液pH=7,则NaOH溶液与硫酸溶液的体积比为 。
(4)100℃时,若10体积的某强酸溶液与1体积的某强碱溶液混合后溶液呈中性,则混合之前强酸溶液的pH与强碱溶液的pH之间应满足的关系是 ____________________________
_____ 。
查看习题详情和答案>>