网址:http://m.1010jiajiao.com/timu_id_386509[举报]
实验室用质量分数为98%,密度为1.84![]() 的硫酸配成1
的硫酸配成1![]() 的稀H2SO4。现实验仅需要这种硫酸240 mL。试回答下列问题:
的稀H2SO4。现实验仅需要这种硫酸240 mL。试回答下列问题:
(1)配制稀硫酸时,应选用容量为 mL的容量瓶;
(2)经计算需要 mL浓硫酸,在量取时宜选用下列量筒中的 。
A.5 mL B.10 mL C.25 mL D.50 mL
(3)配制该硫酸溶液除上述仪器外,还用到的仪器有: 。
(4)在量取浓硫酸后,进行了下列操作:
① 待稀释的硫酸温度与室温一致后,沿玻璃棒注入容量瓶中。
② 往容量瓶中小心加蒸馏水至液面接近环形标线2~3 cm处,改用胶头滴管加蒸馏水,使溶液的凹面底部与瓶颈的环形标线相切。
 ③ 将浓硫酸注入盛有若干毫升蒸馏水的烧杯中,并用玻璃棒搅动,使其混合均匀。
③ 将浓硫酸注入盛有若干毫升蒸馏水的烧杯中,并用玻璃棒搅动,使其混合均匀。
④ 用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。上述操作中,正确的顺序是(填序号) 。
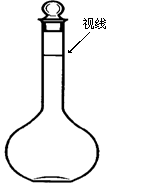
(5)某同学观察液面的情况如图所示,对所配溶液浓度有何影响?会 (填“偏高”、“偏低”、“无影响”)
(6)若出现如下错误操作,所配溶液浓度将偏高还是偏低:没有进行操作步骤④,会 ;加蒸馏水时不慎超过了刻度线,会 。(填“偏高”、“偏低”、“无影响”)
查看习题详情和答案>>NA代表阿伏加德罗常数,下列叙述错误的是
A.10 mL质量分数为98%的H2SO4,用水稀释至100 mL,H2SO4的质量分数为9.8%
B.在H2O2+Cl2=2HCl+O2反应中,每生成32 g氧气,则转移2NA个电子
C.标准状况下,分子数为NA的CO、C2H4混合气体体积约为22.4 L,质量为28 g
D.一定温度下,1 L 0.50 mol?L-1 NH4Cl溶液与2 L 0.25 mol?L-1 NH4Cl溶液含NH+4物质的量不等
查看习题详情和答案>>NA代表阿伏加德罗常数,下列叙述错误的是( )
A.10 mL质量分数为98%的H2SO4,用水稀释至100 mL,H2SO4的质量分数为9.8%
B.在H2O2+Cl2=2HCl+O2反应中,每生成32 g氧气,则转移2NA个电子
C.标准状况下,分子数为NA的CO、C2H4混合气体体积约为22.4 L,质量为28 g
D.一定温度下,1 L 0.50 mol·L-1 NH4Cl溶液与2 L 0.25 mol·L-1 NH4Cl溶液含NH+4物质的量不同
查看习题详情和答案>>| A.10 mL质量分数为98%的H2SO4,用水稀释至100 mL,H2SO4的质量分数为9.8% |
| B.在H2O2+Cl2=2HCl+O2反应中,每生成32 g氧气,则转移2NA个电子 |
| C.标准状况下,分子数为NA的CO、C2H4混合气体体积约为22.4 L,质量为28 g |
| D.一定温度下,1 L 0.50 mol·L-1 NH4Cl溶液与2 L 0.25 mol·L-1 NH4Cl溶液含NH+4物质的量不同 |
NA代表阿伏加德罗常数,下列叙述错误的是( )
| A.10 mL质量分数为98%的H2SO4,用水稀释至100 mL,H2SO4的质量分数为9.8% |
| B.在H2O2+Cl2=2HCl+O2反应中,每生成32 g氧气,则转移2NA个电子 |
| C.标准状况下,分子数为NA的CO、C2H4混合气体体积约为22.4 L,质量为28 g |
| D.一定温度下,1 L 0.50 mol·L-1 NH4Cl溶液与2 L 0.25 mol·L-1 NH4Cl溶液含NH+4物质的量不同 |