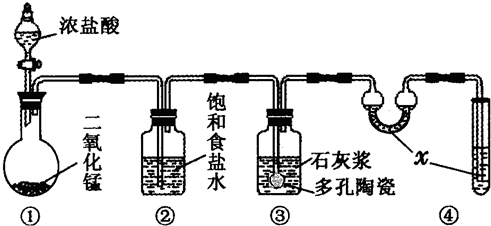
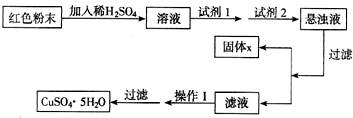
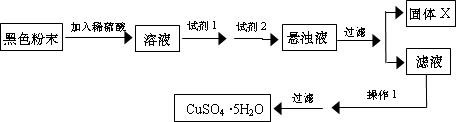
��Ŀ����
ʵ��������������Ϊ98%���ܶ�Ϊ1.84![]() ���������1
���������1![]() ��ϡH2SO4����ʵ�����Ҫ��������240 mL���Իش��������⣺
��ϡH2SO4����ʵ�����Ҫ��������240 mL���Իش��������⣺
��1������ϡ����ʱ��Ӧѡ������Ϊ mL������ƿ��
��2����������Ҫ mLŨ���ᣬ����ȡʱ��ѡ��������Ͳ�е� ��
A��5 mL B��10 mL C��25 mL D��50 mL
��3�����Ƹ�������Һ�����������⣬���õ��������У� ��
��4������ȡŨ������������в�����
�� ��ϡ�͵������¶�������һ�º��ز�����ע������ƿ�С�
�� ������ƿ��С�ļ�����ˮ��Һ��ӽ����α���2��3 cm�������ý�ͷ�ιܼ�����ˮ��ʹ��Һ�İ���ײ���ƿ���Ļ��α������С�
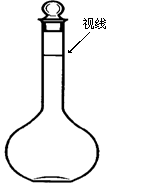 �� ��Ũ����ע��ʢ�����ɺ�������ˮ���ձ��У����ò�����������ʹ���Ͼ��ȡ�
�� ��Ũ����ע��ʢ�����ɺ�������ˮ���ձ��У����ò�����������ʹ���Ͼ��ȡ�
�� ������ˮϴ���ձ��Ͳ�����2��3�Σ�����ϴ��Һȫ��ע������ƿ�����������У���ȷ��˳����(�����) ��
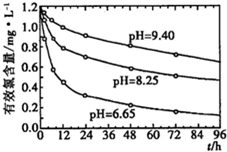
��5��ijͬѧ�۲�Һ��������ͼ��ʾ����������ҺŨ���к�Ӱ�죿�� (�ƫ�ߡ�����ƫ�͡�������Ӱ�족)
��6�����������´��������������ҺŨ�Ƚ�ƫ����ƫ�ͣ�û�н��в�������ܣ��� ��������ˮʱ���������˿̶��ߣ��� ��(�ƫ�ߡ�����ƫ�͡�������Ӱ�족)
��1��250 mL�� ��2�� 13.6mL�� C�� ��3���ձ�������������ͷ�ιܡ� ��4�� �ۢ٢ܢ� �� ��5��ƫ�� �� ��6��ƫ�ͣ�ƫ�� ��
�������:����һ�����ʵ�����Ũ�ȵ���Һ�IJ��輰�����������Ƚ�ģ��������һ�����ʵ�����Ũ�ȵ���Һ��ʵ���Ǹ�����Ҫ��ʵ�顣Ϊ������һ��Ҫ�ѿα���Ҫ��ʵ���ͷ����