网址:http://m.1010jiajiao.com/timu_id_385937[举报]
一、选择题(每小题只有一个选项符合题意,每小题3分,共48分)
题号
1
2
3
4
5
6
7
8
答案
C
A
C
A
B
A
D
D
题号
9
10
11
12
13
14
15
16
答案
B
B
C
D
A
C
B
D
二、填空题:(17题每空3分,第19(2)题3分,其它每空2分,共29分)
17.(CH3)C-CH=CH2 ;(CH3)
18.(1)C25H20 (2) 不 (3)3
.files/image021.gif)
.files/image022.gif) 19.(1)结构简式为 CH3
CH3
19.(1)结构简式为 CH3
CH3
Br ,
CH3
.files/image023.gif) |
CH3
(2)33
20.(1)C6H4S4 5?
(2)n+1-.files/image025.gif) (3)C8H8
(3)C8H8 .files/image026.gif)
三、实验题:( 第一小题3分,其它每小题2分,共13分)
21. (1)写出实验室制取硝基苯化学方程式:
。
(2)催化剂;脱水剂
(3)控制水溶液温度为
(4)试管受热均匀,便于控制温度 (5)使苯蒸气冷凝回流,减少挥发
(6)倒入水中,使用分液漏斗分离下层硝基苯.
四、推断题:( 每空2分,共10分)
五、计算题:(第(1)(2)小题各3分,第(3)小题4分,共10分)
(1)根据.files/image031.gif) →
→.files/image033.gif) 可知,1mol
可知,1mol .files/image031.gif) 生成5mol水,即
生成5mol水,即
(2)反应后和反应前的压强之比即为气体的物质的量之比,设反应消耗氧气的物质的量
为y,则.files/image035.gif) =0.557,y=6.18mol。
=0.557,y=6.18mol。
(3)燃烧后气体物质的量减少:(1+6.18―4)mol=3.18mol,设生成.files/image037.gif) 的丁烷为amol,
的丁烷为amol,
生成CO的丁烷为(1-a)mol,则有:
.files/image031.gif) +
+.files/image039.gif) →
→.files/image041.gif) +
+.files/image033.gif) n
n
1 6.5 4 3.5
a
.files/image043.gif) →4CO+
→4CO+.files/image033.gif) n
n
1 4.5 4 1.5
1-a 1.5(1-a)
由题意:
即丁烷有84%转化为.files/image037.gif) ,16%转化为CO,它们的物质的量分别为:
,16%转化为CO,它们的物质的量分别为:
n(.files/image037.gif) )=4mol×84%=3.36mol n(CO)=4mol×16%=0.64mol
)=4mol×84%=3.36mol n(CO)=4mol×16%=0.64mol
 (2013?通州区二模)碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.
(2013?通州区二模)碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.(1)将CO2与焦炭作用生成CO,CO可用于炼铁等.
①已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJ/mol
C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJ/mol
则CO还原Fe2O3的热化学方程式为
②氯化钯(PdCl2)溶液常被应用于检测空气中微量CO.PdCl2被还原成单质,反应的化学方程式为
(2)将两个石墨电极插入KOH溶液中,向两极分别通入C3H8和O2构成丙烷燃料电池.
①负极电极反应式是:
②某同学利用丙烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色.下列说法中正确的是
A.电源中的a一定为正极,b一定为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H++2e-=H2↑
(3)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:
CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
②实验2中,平衡常数K=
| 1 |
| 6 |
| 1 |
| 6 |
③实验3跟实验2相比,改变的条件可能是
(4)将2.4g碳在足量氧气中燃烧,所得气体通入100mL 3.0mol/L的氢氧化钠溶液中,完全吸收后,溶液中所含离子的物质的量浓度由大到小的顺序
 (1)在298K时,1molC2H6在氧气中完全燃烧生成二氧化碳和液态水放出热量1558.3kJ.写出该反应的热化学方程式
(1)在298K时,1molC2H6在氧气中完全燃烧生成二氧化碳和液态水放出热量1558.3kJ.写出该反应的热化学方程式(2)利用该反应设计一个燃料电池:用氢氧化钾溶液作电解质溶液,多孔石墨做电极,在电极上分别通入乙烷和氧气.通入乙烷气体的电极应为
(3)如图所示实验装置中,石墨棒上的电极反应式为
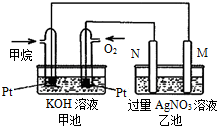 天然气的主要成分甲烷燃烧生成二氧化碳和液态水的热化学方程式如下,请回答下列问题:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-889.6kJ/mol.
天然气的主要成分甲烷燃烧生成二氧化碳和液态水的热化学方程式如下,请回答下列问题:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-889.6kJ/mol.(1)反应物能量总和
(2)若1mol甲烷完全燃烧生成二氧化碳和水蒸气,则放出的热量
(3)已知氢气燃烧生成液态水的热化学方程式是:2H2(g)+O2(g)=2H2O(l)△H=-572kJ/mol,则相同质量的甲烷和氢气,完全燃烧生成液态水,放热较多的是
(4)如图所示的甲池装置是由CH4、O2和KOH溶液组成的新型燃料电池,利用该装置可以将
(5)乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题:
(6)M电极的材料是
(7)在此过程中,乙池中某一电极析出金属银4.32g时,甲池中理论上消耗氧气为
 甲醇被称为21世纪的新型燃料,工业上用CH4和H2O为原料通过下列反应①和②,来制备甲醇。
甲醇被称为21世纪的新型燃料,工业上用CH4和H2O为原料通过下列反应①和②,来制备甲醇。
①CH4(g)+H2O(g)![]() CO(g)+3H2(g) DH1
CO(g)+3H2(g) DH1
②CO(g)+2H2(g)![]() CH3OH(g) DH2
CH3OH(g) DH2
将0.20 mol CH4和0.30 mol H2O(g)通入容积为10 L的密闭容器中,在一定条件下发生反应①,达到平衡时,CH4的转化率与温度、压强的关系如右图。
⑴温度不变,缩小体积,①的逆反应速率 (填“增大”、“减小”或“不变”)。
⑵反应①的DH1 0(填“<”“=”或“>”)100°C时的平衡常数值K= 。
⑶在压强为0.1Mpa条件下,将amolCO与3amolH2的混合气体在催化剂作用下进行反应②再生成甲醇。为了发寻找合成甲醇的适宜的温度和压强,某同学设计了二组实验,部分实验条件已经填在下面实验设计表中。请在空格中填入剩余的实验条件数据。
| 实验编号 | T(°C) | n(CO)/n(H2) | p(MPa) |
| I | 150 | 1/3 | 0.1 |
| II | 5 | ||
| III | 350 | 5 |
300°C时,其他条件不变,将容器的容积压缩到原来的1/2,对平衡体系产生的影响是(填字母)( )
A.c(H2)减少 B.正反应速率加快,逆反应速率减慢
C.CH3OH的物质的量增加 D.重新平衡时c(H2)/c(CH2OH)减小
⑷已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)DH=-1275.6 kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) DH=-556.0 kJ·mol-1
 ③H2O(g)=H2O(l)DH=-44.0 kJ·mol-1
③H2O(g)=H2O(l)DH=-44.0 kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳的液态水的热化学方程式 。
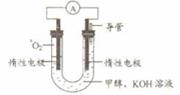
⑸某实验小组依据甲醇燃烧的反应原理,设计如右图所示的电池装置。
①该电池正极的电极反应为 。
②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为
。
查看习题详情和答案>> 甲醇被称为21世纪的新型燃料,工业上用CH4和H2O为原料通过下列反应①和②,来制备甲醇。
甲醇被称为21世纪的新型燃料,工业上用CH4和H2O为原料通过下列反应①和②,来制备甲醇。
①CH4(g)+H2O(g)![]() CO(g)+3H2(g) DH1
CO(g)+3H2(g) DH1
②CO(g)+2H2(g)![]() CH3OH(g) DH2
CH3OH(g) DH2
将0.20 mol CH4和0.30 mol H2O(g)通入容积为10 L的密闭容器中,在一定条件下发生反应①,达到平衡时,CH4的转化率与温度、压强的关系如右图。
⑴温度不变,缩小体积,①的逆反应速率 (填“增大”、“减小”或“不变”)。
⑵反应①的DH1 0(填“<”“=”或“>”)100°C时的平衡常数值K= 。
⑶在压强为0.1Mpa条件下,将amolCO与3amolH2的混合气体在催化剂作用下进行反应②再生成甲醇。为了发寻找合成甲醇的适宜的温度和压强,某同学设计了二组实验,部分实验条件已经填在下面实验设计表中。请在空格中填入剩余的实验条件数据。
| 实验编号 | T(°C) | n(CO)/n(H2) | p(MPa) |
| I | 150 | 1/3 | 0.1 |
| II | 5 | ||
| III | 350 | 5 |
300°C时,其他条件不变,将容器的容积压缩到原来的1/2,对平衡体系产生的影响是(填字母)( )
A.c(H2)减少 B.正反应速率加快,逆反应速率减慢
C.CH3OH的物质的量增加 D.重新平衡时c(H2)/c(CH2OH)减小
⑷已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)DH=-1275.6 kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) DH=-556.0 kJ·mol-1
③H2O(g)=H2O(l)DH=-44.0 kJ·mol-1
 写出甲醇不完全燃烧生成一氧化碳的液态水的热化学方程式 。
写出甲醇不完全燃烧生成一氧化碳的液态水的热化学方程式 。
⑸某实验小组依据甲醇燃烧的反应原理,设计如右图所示的电池装置。
①该电池正极的电极反应为 。
②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为
。
查看习题详情和答案>>.files/image027.gif)
.files/image029.jpg)