摘要:(1) Na NaHCO3 NaCl Cl2NaHCO3= HCO3- + Na+(5)2Na+2H2O=2Na+ +2OH-- +H2 OH--+CO2=HCO3- HCO3-+ H+=CO2+ H2O 2Na+ Cl2点燃2NaCl
网址:http://m.1010jiajiao.com/timu_id_382960[举报]
(2011?朝阳区二模)已知甲、乙、丙均为常见气体,其中甲在空气中含量最多,乙在相同条件下密度最小,丙有刺激性气味,且一个丙分子由四个原子构成.
(1)实验室中可用下图A或B装置与相应的药品制得丙.
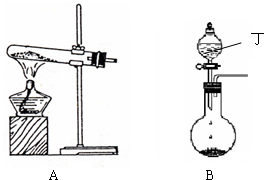
①A中试管内反应的化学方程式是
②B中分液漏斗内盛放的物质丁是
(2)工业上将甲和乙在高温、高压、催化剂的条件下制取丙.下图是甲和乙反应过程中能量变化图:
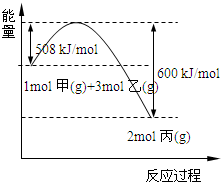
该反应的热化学方程式是
(3)丙在氧气中燃烧的反应是置换反应,该反应的化学方程式是
(4)①将丙和CO2气体通入饱和食盐水中有碳酸氢钠晶体析出,反应的离子方程式是
②为了验证上述晶体既不是NH4HCO3、也不是NaCl而是NaHCO3,设计实验方案如下,完成下列部分实验报告:
(5)若用(1)中得A制取丙,并用园底烧瓶通过排气法收集丙(标准状况),然后进行喷泉实验.当水进入到烧瓶体积得3/5时,液面不再上升,此时立即关闭止水夹,烧瓶内溶液中溶质的物质的量浓度是
查看习题详情和答案>>
(1)实验室中可用下图A或B装置与相应的药品制得丙.

①A中试管内反应的化学方程式是
2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O
| ||
2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O
.
| ||
②B中分液漏斗内盛放的物质丁是
浓氨水
浓氨水
,圆底烧瓶内的物质是氧化钙(氢氧化钠或碱石灰)
氧化钙(氢氧化钠或碱石灰)
.(均填名称)(2)工业上将甲和乙在高温、高压、催化剂的条件下制取丙.下图是甲和乙反应过程中能量变化图:

该反应的热化学方程式是
N2(g)+3H2(g)?2NH3(g);△H=-92kJ/mol
N2(g)+3H2(g)?2NH3(g);△H=-92kJ/mol
.(3)丙在氧气中燃烧的反应是置换反应,该反应的化学方程式是
4NH3+3O2
2N2+6H2O
| ||
4NH3+3O2
2N2+6H2O
.
| ||
(4)①将丙和CO2气体通入饱和食盐水中有碳酸氢钠晶体析出,反应的离子方程式是
NH3+CO2+H2O+Na+=NaHCO3↓+NH4+
NH3+CO2+H2O+Na+=NaHCO3↓+NH4+
.②为了验证上述晶体既不是NH4HCO3、也不是NaCl而是NaHCO3,设计实验方案如下,完成下列部分实验报告:
| 实验操作 | 实验现象 | 结论 | 相应的离子方程式 |
| 取少量晶体于试管中,充分加热 | 试管内有固体剩余 | 该晶体不是NH4HCO3 该晶体不是NH4HCO3 |
无离子方程式 无离子方程式 |
向冷却后试管中加入足量盐酸 向冷却后试管中加入足量盐酸 |
固体全部溶解,有气泡产生 | 该晶体不是NaCl是NaHCO3 该晶体不是NaCl是NaHCO3 |
CO32-+2H+=H2O+CO2↑ CO32-+2H+=H2O+CO2↑ |
0.0045
0.0045
mol/L(精确到0.001).(2012?泉州一模)反应物间进行微粒交换是化学反应的特征之一,置换反应、复分解反应、取代反应都属于反应物间进行微粒交换的化学反应.
(1)NaHCO3和NaOH的反应是NaHCO3电离的H+离子和NaOH电离出的
(2)在浓硫酸作用下,羧酸与醇间的反应属于微粒交换反应,乙酸和乙醇反应的化学方程式为
(3)工业上制取粗硅的反应是一个置换反应,此反应的氧化产物是
(4)NH3和Cl2发生置换反应,当NH3过量时,NH3继续与HCl反应.当有3mlolCl2参与反应时,有
(5)(NH4)2CO3和H2CO3的反应也是微粒交换反应,当向(NH4)2CO3溶液中通入一定量CO2至溶液呈中性时,溶液中HCO3-和NH4+的比值
查看习题详情和答案>>
(1)NaHCO3和NaOH的反应是NaHCO3电离的H+离子和NaOH电离出的
Na+
Na+
离子相互交换的反应.(2)在浓硫酸作用下,羧酸与醇间的反应属于微粒交换反应,乙酸和乙醇反应的化学方程式为
CH3COOH+CH3CH2OH
CH3COOCH2CH3+H2O
| 催化剂 |
| 加热 |
CH3COOH+CH3CH2OH
CH3COOCH2CH3+H2O
.| 催化剂 |
| 加热 |
(3)工业上制取粗硅的反应是一个置换反应,此反应的氧化产物是
CO
CO
(写化学式)(4)NH3和Cl2发生置换反应,当NH3过量时,NH3继续与HCl反应.当有3mlolCl2参与反应时,有
2
2
molNH3被氧化.(5)(NH4)2CO3和H2CO3的反应也是微粒交换反应,当向(NH4)2CO3溶液中通入一定量CO2至溶液呈中性时,溶液中HCO3-和NH4+的比值
小于
小于
(填“大于”、“小于”或“等于”)1:1. 下列物质 ①Cu ②液态SO2 ③纯醋酸 ④NaHCO3 ⑤Ba(OH)2溶液
下列物质 ①Cu ②液态SO2 ③纯醋酸 ④NaHCO3 ⑤Ba(OH)2溶液I.属于非电解质的是
②
②
;(填序号)Ⅱ.(1)NaHCO3是一种
强
强
(填“强”或“弱”)电解质;(2)写出HCO3-水解的离子方程式:
HCO3-+H2O H2CO3+OH-
H2CO3+OH-
 H2CO3+OH-
H2CO3+OH-HCO3-+H2O H2CO3+OH-
H2CO3+OH-
; H2CO3+OH-
H2CO3+OH-(3)常温下,0.1mol?L-1NaHCO3溶液的pH大于8,则溶液中Na+、HCO3-、H2CO3、CO32-、OH -五种微粒的浓度由大到小的顺序为:
c(Na+)>c(HCO3-)>c(OH-)>c(H2CO3)>c(CO32-)
c(Na+)>c(HCO3-)>c(OH-)>c(H2CO3)>c(CO32-)
.Ⅲ.Ba(OH)2是一种强电解质,现有25℃、pH=13的Ba(OH)2溶液.
(1)该Ba(OH)2溶液的物质的量浓度为
0.05mol/L
0.05mol/L
;(2)溶液中由水电离出c(OH -)=
10-13mol/L
10-13mol/L
;(3)与某浓度盐酸溶液按体积比(碱与酸之比)1:9混合后,所得溶液pH=11(假设混合溶液的体积等于混合前两溶液的体积和),该盐酸溶液的pH=
0.01mol/L
0.01mol/L
.Ⅳ.醋酸是一种弱电解质. 某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如右图所示.则图
Ⅱ
Ⅱ
(填“I”或“Ⅱ”)为醋酸稀释的图象.