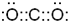网址:http://m.1010jiajiao.com/timu_id_36201[举报]
说明:1、文字简答题以关键词到位为准,按点给分;
2、化学用语书写:(1)方程式未配平不得分、无条件扣一半分值;
(2)化学式书写错误得0分;
3、写名称或化学式正确的正常给分;
4、其他合理解法正常给分。
第Ⅰ卷(选择题,共64分)
一、二:选择题
题 号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
答 案
B
A
C
D
D
B
A
C
AD
AC
C
B
AD
B
CD
D
第Ⅱ卷(非选择题 共86分)
三、(共2小题,22分)
17.(8分)
(1)ABDC(2分)(颠倒不得分)
(2)左(1分), 继续往左盘小烧杯中慢慢加少量样品,使指针指向标尺中间,直至天平平衡(1分)
(3)引流(1分) 防止液体局部过热,液滴溅出(1分)
(4)沉淀后静置,向上层清液中加入CaCl2溶液,观察是否有沉淀生成,若无沉淀生成,则说明沉淀完全,反之则沉淀不完全。(1分)取最后一次洗涤液少许,滴入数滴K2CO3溶液(或AgNO3溶液等也可),若无沉淀产生,即沉淀洗涤干净。(1分)
18(共14分)
(1)分液漏斗(1分)。Cu+4H++2NO3―=Cu2++2NO2↑+2H2O(或NO的方程式也可)(2分)。
(2)安全瓶(防止倒吸等)(1分)
(3)①坩埚(1分) ②b(1分) ③Cu+H2O2+2H+=Cu2++2H2O(2分)
④防止双氧水分解(1分),酒精与水互溶且极易挥发,减少晶体溶解(1分),第二组(2分)
理由:第一组中的方案1需要加热,消耗能源,方案2所得产品含有铁元素杂质。而第二组方案几乎不产生有害气体,且所得产品纯度较高。(2分)
四、(共2小题,18分)
19、(8分)(1)三角锥型、平面三角形、四面体(一个1分,共3分)
(2)H2O2、C2H6、CH3NH2、N2H4(H2N―NH2)(各1分,共2分,任写2种),O22―(1分)
 (2分) (2)K3Fe(C2O4)3 (2分)(3)3CO+Fe2O3===2Fe+3CO2(2分)
(2分) (2)K3Fe(C2O4)3 (2分)(3)3CO+Fe2O3===2Fe+3CO2(2分) (2分)
(2分) (1分) C:
(1分) C: (1分)
(1分)

 24x+28×3+16y+18×4= 332
24x+28×3+16y+18×4= 332 (2分)
(2分) 2x=3y (2分)
2x=3y (2分) m
(2分) m = 58.5 t
(2分)
m
(2分) m = 58.5 t
(2分)