网址:http://m.1010jiajiao.com/timu_id_35880[举报]
选择题:6、A 7、D 8、B 9、B 10、A 11、A 12、C 13、D
26、(15分)
(1) ;水合氢离子;第3周期、ⅢA族。
;水合氢离子;第3周期、ⅢA族。
(2)Al3++3NH3∙H2O =Al(OH)3↓+3NH4+ Al(OH)3+OH? = AlO2?+2H2O
(3)①NH4Al(SO4)2 = NH4++Al3++2SO42? ② a、c、b、e、d。
③200ml;
27、(15分)(每空3分)

28、(14分)(1)天平(1分);250mL的容量瓶(1分);
(2)不需要(1分),紫色不褪色(1分)。 (3)2Na2SO3+O2→2Na2SO4(2分)
(4) (2分);
(2分);
(5)盐酸提供H+,Ba(NO3)2提供NO3- 形成稀HNO3,将一部分SO32-氧化成SO42-,遇Ba2+结合生成BaSO4沉淀,沉淀质量偏大,导致含量偏高(3分)。
(6)称取样品m
29、(16分)
(1) ―
― ―H (1分) ClCH2
―H (1分) ClCH2 (1分)
CH3CH2OH(1分)
(1分)
CH3CH2OH(1分)
(2)①②⑤(2分)
(3)(方程式2+2分)2 ClCH2 CH2
OH + O2→2 ClCH2  ―H +2H2O
―H +2H2O
ClCH2 ―OH+C2H5OH
―OH+C2H5OH ClCH2
ClCH2 ―OC2H5+H2O
―OC2H5+H2O
(4)① 12.5 mol(2分) ②碳碳双键、羧基、羟基(3分)
③ 略(2分)
理
综(
生物部分参考答案
一、选择题(每题6分,共30分)
1
2
3
4
5
D
A
C
D
A
二、非选择题
30.(22分)(1)(3y-2z-x)/
(2)①1号杯对应空格 无 ;3号杯对应空格 低 ;5号杯对应空格 有 ;(每空2分)
②通过调节日光灯与烧杯的距离来得到不同光强(2分)
冷开水中不含CO2,用玻璃管向冷开水中吹气,可得到有CO2较多的溶液。(2分)
③ 2号 ; 2号和3号或5号和6号 ;(每空2分)
适当提高光照强度能提高光合作用速率 ;(2分)
④叶片进行光合作用,释放出O2多于呼吸作用消耗的O2,叶肉细胞间隙中的O2积累,叶片上浮。(3分)
31.(共20分)
Ⅰ(1) 1/6 ; 5/12 ;(2) 1/6 ;(3) 1/12 ;(每空3分)
Ⅱ实验方案(4分):
①取多株F1植株,和纯种无色皱缩的玉米进行测交
②收获测交后代的种子并统计不同表现型的数量比例。
推断(4分):
如果有四种表现型,比例接近1∶1∶1∶1,则符合基因的自由组合定律;若不出现四种表现型,或四种表现型比例不是接近1∶1∶1∶1,则不符合。
或实验方案:
①取多株F1植株自交
②收获自交后代的种子并统计不同表现型的数量比例。
推断:
如果有四种表现型,比例接近9∶3∶3∶1,则符合基因的自由组合定律;若不出现四种表现型,或四种表现型比例不是接近9∶3∶3∶1,则不符合。
或实验方案:
①取多株F1植株的花粉,进行花药离体培养,获得单倍体植株;再用秋水仙素处理幼苗,长成植株后自交。
②收获自交后代的种子并统计不同表现型的数量比例。
推断:
如果有四种表现型,比例接近1∶1∶1∶1,则符合基因的自由组合定律;若不出现四种表现型,或四种表现型比例不是接近1∶1∶1∶1,则不符合。
(15分)某校某班化学兴趣小组进行了下列两项试验活动:(1)探究草酸(H2C2O4)与高锰酸钾溶液在不同条件下反应的快慢;(2)测定草酸晶体的纯度。已知:① 在酸性环境下的还原产物是
在酸性环境下的还原产物是 ;②草酸是二元弱酸。
;②草酸是二元弱酸。
Ⅰ.探究草酸与高锰酸钾溶液在不同条件下反应的快慢
取4支试管,分别加入 的草酸溶液
的草酸溶液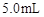 ,按下表中四种方案分别加入相应的试剂,使其发生反应。四支试管中均可观察到有气泡产生,且溶液的颜色变化都为:紫红色→红色→橙红色→橙色→黄色→无色,溶液褪为无色所需的时间如下表所示(表中“—”表示未加入该试剂)。
,按下表中四种方案分别加入相应的试剂,使其发生反应。四支试管中均可观察到有气泡产生,且溶液的颜色变化都为:紫红色→红色→橙红色→橙色→黄色→无色,溶液褪为无色所需的时间如下表所示(表中“—”表示未加入该试剂)。
|
实验 编号 |
反应温度 (利用水浴加热) |
稀硫酸溶液 |
|
|
褪色时间 |
|
1 |
65℃ |
— |
— |
1.0mL |
100s |
|
2 |
65℃ |
10滴 |
— |
1.0mL |
90s |
|
3 |
75℃ |
10滴 |
— |
1.0mL |
40s |
|
4 |
75℃ |
10滴 |
加入少许 |
1.0mL |
3s |
根据以上4组实验,可以得出的结论主要有_______________________________。
Ⅱ.测定草酸晶体的纯度
用托盘天平称取草酸晶体 样品
样品 ;配制成
;配制成 溶液;每次移取25.00mL该溶液于锥形瓶中,用0.10mol/L酸性高锰酸钾溶液滴定;滴定实验重复操作2—3次。请回答:
溶液;每次移取25.00mL该溶液于锥形瓶中,用0.10mol/L酸性高锰酸钾溶液滴定;滴定实验重复操作2—3次。请回答:
(1)实验中需要用到的玻璃仪器除了玻璃棒、烧杯、锥形瓶、胶头滴管、250mL容量瓶外还需要的一种玻璃仪器是____________。(填仪器名称)
(2)上述 溶液与酸性
溶液与酸性 溶液反应的离子方程式为_________。
溶液反应的离子方程式为_________。
(3)若滴定过程中平均消耗酸性高锰酸钾溶液VmL,则草酸晶体的纯度为_______(以含W、V的表达式表示)。
查看习题详情和答案>>
(13分)某校某班化学兴趣小组进行了下列两项试验活动:(1)探究草酸(H2C2O4)与高锰酸钾溶液在不同条件下反应的快慢;(2)测定草酸晶体的纯度。已知:① 在酸性环境下的还原产物是
在酸性环境下的还原产物是 ;②草酸是二元弱酸。
;②草酸是二元弱酸。
Ⅰ.探究草酸与高锰酸钾溶液在不同条件下反应的快慢
取4支试管,分别加入 的草酸溶液
的草酸溶液 ,按下表中四种方案分别加入相应的试剂,使其发生反应。四支试管中均可观察到有气泡产生,且溶液的颜色变化都为:紫红色→红色→橙红色→橙色→黄色→无色,溶液褪为无色所需的时间如下表所示(表中“—”表示未加入该试剂)。
,按下表中四种方案分别加入相应的试剂,使其发生反应。四支试管中均可观察到有气泡产生,且溶液的颜色变化都为:紫红色→红色→橙红色→橙色→黄色→无色,溶液褪为无色所需的时间如下表所示(表中“—”表示未加入该试剂)。
|
实验 编号 |
反应温度 (利用水浴加热) |
稀硫酸溶液 |
|
|
褪色时间 |
|
1 |
65℃ |
— |
— |
1.0mL |
100s |
|
2 |
65℃ |
10滴 |
— |
1.0mL |
90s |
|
3 |
75℃ |
10滴 |
— |
1.0mL |
40s |
|
4 |
75℃ |
10滴 |
加入少许 |
1.0mL |
3s |
根据以上4组实验,可以得出的结论主要有_______________________________。
Ⅱ.测定草酸晶体的纯度
用托盘天平称取草酸晶体 样品
样品 ;配制成
;配制成 溶液;每次移取25.00mL该溶液于锥形瓶中,用0.10mol/L酸性高锰酸钾溶液滴定;滴定实验重复操作2—3次。请回答:
溶液;每次移取25.00mL该溶液于锥形瓶中,用0.10mol/L酸性高锰酸钾溶液滴定;滴定实验重复操作2—3次。请回答:
(1)实验中需要用到的玻璃仪器除了玻璃棒、烧杯、锥形瓶、胶头滴管、250mL容量瓶外还需要的一种玻璃仪器是____________。(填仪器名称)
(2)上述 溶液与酸性
溶液与酸性 溶液反应的离子方程式为_________。
溶液反应的离子方程式为_________。
(3)若滴定过程中平均消耗酸性高锰酸钾溶液VmL,则草酸晶体的纯度为_______(以含W、V的表达式表示)。
查看习题详情和答案>>
某校某班化学兴趣小组进行了下列两项试验活动:(1)探究草酸(H2C2O4)与高锰酸钾溶液在不同条件下反应的快慢;(2)测定草酸晶体的纯度。已知:①![]() 在酸性环境下的还原产物是
在酸性环境下的还原产物是![]() ;②草酸是二元弱酸。
;②草酸是二元弱酸。
Ⅰ.探究草酸与高锰酸钾溶液在不同条件下反应的快慢
取4支试管,分别加入![]() 的草酸溶液
的草酸溶液![]() ,按下表中四种方案分别加入相应的试剂,使其发生反应。四支试管中均可观察到有气泡产生,且溶液的颜色变化都为:紫红色→红色→橙红色→橙色→黄色→无色,溶液褪为无色所需的时间如下表所示(表中“—”表示未加入该试剂)。
,按下表中四种方案分别加入相应的试剂,使其发生反应。四支试管中均可观察到有气泡产生,且溶液的颜色变化都为:紫红色→红色→橙红色→橙色→黄色→无色,溶液褪为无色所需的时间如下表所示(表中“—”表示未加入该试剂)。
| 实验 编号 | 反应温度 (利用水浴加热) | 稀硫酸溶液 |
|
| 褪色时间 |
| 1 | 65℃ | — | — | 1.0mL | 100s |
| 2 | 65℃ | 10滴 | — | 1.0mL | 90s |
| 3 | 75℃ | 10滴 | — | 1.0mL | 40s |
| 4 | 75℃ | 10滴 | 加入少许 | 1.0mL | 3s |
根据以上4组实验,可以得出的结论主要有_______________________________。
Ⅱ.测定草酸晶体的纯度
用托盘天平称取草酸晶体![]() 样品
样品![]() ;配制成
;配制成![]() 溶液;每次移取25.00mL该溶液于锥形瓶中,用0.10mol/L酸性高锰酸钾溶液滴定;滴定实验重复操作2—3次。请回答:
溶液;每次移取25.00mL该溶液于锥形瓶中,用0.10mol/L酸性高锰酸钾溶液滴定;滴定实验重复操作2—3次。请回答:
(1) 实验中需要用到的玻璃仪器除了玻璃棒、烧杯、锥形瓶、胶头滴管、250mL容量瓶外还需要的一种玻璃仪器是____________。(填仪器名称)
(2) 上述![]() 溶液与酸性
溶液与酸性![]() 溶液反应的离子方程式为_________。
溶液反应的离子方程式为_________。
(3) 若滴定过程中平均消耗酸性高锰酸钾溶液VmL,则草酸晶体的纯度为_______(以含W、V的表达式表示)。
查看习题详情和答案>>①MnO4-在酸性环境下的还原产物是Mn2+ ②2KClO3
| ||
| △ |
| ||
【实验用品】仪器:试管(若干个)、胶头滴管、100mL容量瓶、250mL容量瓶、10mL量筒、托盘天平、玻璃棒、烧杯、药匙
试剂:草酸晶体( H2C2O4?2H2O、0.01mol/L KMnO4溶液、稀硫酸、MnSO4固体
【实验内容】
(1)0.10mol/L H2C2O4溶液的配制:
实验室欲配制100mL 0.10mol/L H2C2O4溶液,需要称取草酸晶体
(2)反应的速率变化的探究:
在1号和2号试管中分别加入2mL0.10mol/L H2C2O4溶液,在1号试管中加入硫酸锰固体.然后在两支试管中加入4mL 0.010mol/L
KMnO4溶液和几滴稀硫酸.现做如下对比实验,现象如下表所示:
| 加入药品 | 不加MnSO4的硫酸 酸化的H2C2O4溶液 |
加少量MnSO4的硫酸 酸化的H2C2O4溶液 |
| 实验现象 (褪色时间)/s |
H2C2O4褪色很慢 (31秒) |
H2C2O4褪色很快(4秒) |
①甲同学进行该实验还缺少的实验仪器是:
②H2C2O4溶液与酸性的KMnO4溶液反应的离子方程式为:
③甲同学测出的褪色时间是以下列哪个选项为依据的
A、从KMnO4溶液滴加到刚好接触H2C2O4溶液开始,溶液由紫红色变为近乎无色,半分钟之内不再出现紫红色为止.
B、从KMnO4溶液滴加到刚好接触H2C2O4溶液开始,溶液由无色变为紫红色为止.
C、从KMnO4溶液滴加到刚好接触H2C2O4溶液开始,溶液由紫红色变为近乎无色为止.
④甲同学认为该反应褪色由慢到快的原因是
(3)乙同学和丙同学从甲同学的实验探究中得到启示,他们也分别提出了能影响该溶液化学反应速率因素的另外两种可能原因,你认为他们提出的两种可能原因是:I

I.请根据上面流程,圆答以下问题:
(1)操作I所用到的玻璃仪器除烧杯、玻璃棒外,还必须有
(2)将沉淀物加热,冷却至室温,用天平称量其质量为b1 g,再次加热并冷却至室温称量其质量为b2 g,若b1-b2
(3)若蒸发皿质量是W1g,蒸发皿与加热后固体总质量是W2g,则样品中铁元素的质量分数是
| 1120(W2-W1) |
| 160a |
| 1120(W2-W1) |
| 160a |
II.有同学提出,还可以采用以下方法来测定:

(4)在量取待测液和滴定过程中需要用到的滴定管是
A.一支酸式滴定管和一支碱式滴定管 B两支酸式滴定管 C两支碱式滴定管
(5)滴定终点的现象为
(6)若滴定用掉c mol/L KMnO4溶液bmL,则样品中铁元素的质量分数是
| 14bc |
| 5a |
| 14bc |
| 5a |
(7)在试验过程中,下列操作可能造成铁元素的质量分数偏高的是
A.溶解样品时用稀盐酸代替稀硫酸
B.用铁单质做还原剂
C.量取滤液时未润洗对应滴定管
D.滴定前读数时满定管内无气泡,滴定后有气泡残留在滴定管尖端
E.配制c mol/L KMnO4标准溶液时未将洗涤液一并转移入容量瓶
F.试验时在锥形瓶中放了25.5mL含有Fe2+的待测液.
 固体
固体 固体
固体