网址:http://m.1010jiajiao.com/timu_id_35866[举报]
选择题:6、A 7、D 8、B 9、B 10、A 11、A 12、C 13、D
26、(15分)
(1) ;水合氢离子;第3周期、ⅢA族。
;水合氢离子;第3周期、ⅢA族。
(2)Al3++3NH3∙H2O =Al(OH)3↓+3NH4+ Al(OH)3+OH? = AlO2?+2H2O
(3)①NH4Al(SO4)2 = NH4++Al3++2SO42? ② a、c、b、e、d。
③200ml;
27、(15分)(每空3分)

28、(14分)(1)天平(1分);250mL的容量瓶(1分);
(2)不需要(1分),紫色不褪色(1分)。 (3)2Na2SO3+O2→2Na2SO4(2分)
(4) (2分);
(2分);
(5)盐酸提供H+,Ba(NO3)2提供NO3- 形成稀HNO3,将一部分SO32-氧化成SO42-,遇Ba2+结合生成BaSO4沉淀,沉淀质量偏大,导致含量偏高(3分)。
(6)称取样品m
29、(16分)
(1) ―
― ―H (1分) ClCH2
―H (1分) ClCH2 (1分)
CH3CH2OH(1分)
(1分)
CH3CH2OH(1分)
(2)①②⑤(2分)
(3)(方程式2+2分)2 ClCH2 CH2
OH + O2→2 ClCH2  ―H +2H2O
―H +2H2O
ClCH2 ―OH+C2H5OH
―OH+C2H5OH ClCH2
ClCH2 ―OC2H5+H2O
―OC2H5+H2O
(4)① 12.5 mol(2分) ②碳碳双键、羧基、羟基(3分)
③ 略(2分)
理
综(
生物部分参考答案
一、选择题(每题6分,共30分)
1
2
3
4
5
D
A
C
D
A
二、非选择题
30.(22分)(1)(3y-2z-x)/
(2)①1号杯对应空格 无 ;3号杯对应空格 低 ;5号杯对应空格 有 ;(每空2分)
②通过调节日光灯与烧杯的距离来得到不同光强(2分)
冷开水中不含CO2,用玻璃管向冷开水中吹气,可得到有CO2较多的溶液。(2分)
③ 2号 ; 2号和3号或5号和6号 ;(每空2分)
适当提高光照强度能提高光合作用速率 ;(2分)
④叶片进行光合作用,释放出O2多于呼吸作用消耗的O2,叶肉细胞间隙中的O2积累,叶片上浮。(3分)
31.(共20分)
Ⅰ(1) 1/6 ; 5/12 ;(2) 1/6 ;(3) 1/12 ;(每空3分)
Ⅱ实验方案(4分):
①取多株F1植株,和纯种无色皱缩的玉米进行测交
②收获测交后代的种子并统计不同表现型的数量比例。
推断(4分):
如果有四种表现型,比例接近1∶1∶1∶1,则符合基因的自由组合定律;若不出现四种表现型,或四种表现型比例不是接近1∶1∶1∶1,则不符合。
或实验方案:
①取多株F1植株自交
②收获自交后代的种子并统计不同表现型的数量比例。
推断:
如果有四种表现型,比例接近9∶3∶3∶1,则符合基因的自由组合定律;若不出现四种表现型,或四种表现型比例不是接近9∶3∶3∶1,则不符合。
或实验方案:
①取多株F1植株的花粉,进行花药离体培养,获得单倍体植株;再用秋水仙素处理幼苗,长成植株后自交。
②收获自交后代的种子并统计不同表现型的数量比例。
推断:
如果有四种表现型,比例接近1∶1∶1∶1,则符合基因的自由组合定律;若不出现四种表现型,或四种表现型比例不是接近1∶1∶1∶1,则不符合。
A组:量取25.00 mL上述溶液,加入足量的BaCl2溶液,过滤、洗涤、干燥沉淀,称得沉淀的质量为m g。
B组:量取25.00 mL上述溶液,在酚酞作指示剂的条件下,用a mol·L-1的盐酸进行滴定,消耗的盐酸的体积为b mL。
(1)准确称取W g固体样品后,配制250 mL溶液时,所用到的仪器有__________;
(2)洗涤沉淀的方法是__________;
(3)实验时,沉淀可以在__________ (填序号)中进行干燥;
A.装有P2O5的球形干燥管
B.装有生石灰的干燥器
C.装有浓硫酸的洗气瓶
(4)用B组的实验数据,则Na2CO3的纯度为_________________________________。
查看习题详情和答案>>Ⅰ.下图为常见仪器的部分结构(有的仪器被放大)
图A中液面所示溶液的体积为 mL,用上述四种仪器中的某种测量一液体的体积,平视时读数为n mL,仰视时读数为m mL,若m>n,则所使用的仪器是 (填字母标号)。
Ⅱ.某学生用标准0.25 mol·L—1 NaOH溶液滴定硫酸的实验操作如下:
A.用酸式滴定管取稀H2SO4 25.00 mL,注入锥形瓶中,加入指示剂。
B.用待测定的溶液润洗酸式滴定管。 C.用蒸馏水洗干净滴定管。
D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2~3 cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下。
E.检查滴定管是否漏水。 F.另取锥形瓶,再重复操作一次。
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
①滴定操作的正确顺序是(用序号填): 。
②该滴定操作中应选用的指示剂是: 。
③在G操作中如何确定终? 。
④碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果(填“偏小”、“偏大”或“恰好合适”) ,原因是 。
⑤假设操作均正确,标准液消耗了22.18mL,计算待测硫酸溶液的物质的量浓度(计算结果精确到小数点后二位) mol·L—1
Ⅲ.已知常温时醋酸的电离常数为1.8×10-5,一水合氨的电离常数为1.8×10-5。在少量Mg(OH)2悬浊液中,滴加适量饱和NH4Cl溶液,固体溶解。对于固体的溶解。
甲同学认为在氢氧化镁悬浊液中存在下列平衡:
Mg(OH)2 Mg2+ +2OH-
加入NH4Cl溶液,由于NH4+水解产生H+中和了Mg(OH)2电离产生的OH-而使平衡右移导致Mg(OH)2 溶解。
而乙同学却认为NH4Cl电离产生的NH4+结合了OH-生成了弱电解质NH3·H2O,使c(OH-)减小,平衡右移而导致Mg(OH)2 溶解。设计方案评价甲乙两位同学的观点:
_____________________________________ ______________________________
_________________________________________________________________________
查看习题详情和答案>>
Ⅰ.下图为常见仪器的部分结构(有的仪器被放大)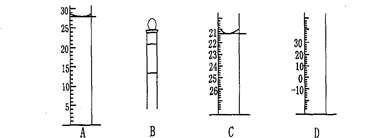
图A中液面所示溶液的体积为 mL,用上述四种仪器中的某种测量一液体的体积,平视时读数为n mL,仰视时读数为m mL,若m>n,则所使用的仪器是 (填字母标号)。
Ⅱ.某学生用标准0.25 mol·L—1 NaOH溶液滴定硫酸的实验操作如下:
| A.用酸式滴定管取稀H2SO4 25.00 mL,注入锥形瓶中,加入指示剂。 | |
| B.用待测定的溶液润洗酸式滴定管。 | C.用蒸馏水洗干净滴定管。 |
| D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2~3 cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下。 |
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
①滴定操作的正确顺序是(用序号填): 。
②该滴定操作中应选用的指示剂是: 。
③在G操作中如何确定终? 。
④碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果(填“偏小”、“偏大”或“恰好合适”) ,原因是 。
⑤假设操作均正确,标准液消耗了22.18mL,计算待测硫酸溶液的物质的量浓度(计算结果精确到小数点后二位) mol·L—1
Ⅲ.已知常温时醋酸的电离常数为1.8×10-5,一水合氨的电离常数为1.8×10-5。在少量Mg(OH)2悬浊液中,滴加适量饱和NH4Cl溶液,固体溶解。对于固体的溶解。
甲同学认为在氢氧化镁悬浊液中存在下列平衡:
Mg(OH)2
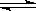 Mg2+ +2OH-
Mg2+ +2OH-加入NH4Cl溶液,由于NH4+水解产生H+中和了Mg(OH)2电离产生的OH-而使平衡右移导致Mg(OH)2 溶解。
而乙同学却认为NH4Cl电离产生的NH4+结合了OH-生成了弱电解质NH3·H2O,使c(OH-)减小,平衡右移而导致Mg(OH)2 溶解。设计方案评价甲乙两位同学的观点:
_____________________________________ ______________________________
_________________________________________________________________________ 查看习题详情和答案>>
Ⅰ.下图为常见仪器的部分结构(有的仪器被放大)

图A中液面所示溶液的体积为 mL,用上述四种仪器中的某种测量一液体的体积,平视时读数为n mL,仰视时读数为m mL,若m>n,则所使用的仪器是 (填字母标号)。
Ⅱ.某学生用标准0.25 mol·L—1 NaOH溶液滴定硫酸的实验操作如下:
A.用酸式滴定管取稀H2SO4 25.00 mL,注入锥形瓶中,加入指示剂。
B.用待测定的溶液润洗酸式滴定管。 C.用蒸馏水洗干净滴定管。
D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2~3 cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下。
E.检查滴定管是否漏水。 F.另取锥形瓶,再重复操作一次。
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
①滴定操作的正确顺序是(用序号填): 。
②该滴定操作中应选用的指示剂是: 。
③在G操作中如何确定终? 。
④碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果(填“偏小”、“偏大”或“恰好合适”) ,原因是 。
⑤假设操作均正确,标准液消耗了22.18mL,计算待测硫酸溶液的物质的量浓度(计算结果精确到小数点后二位) mol·L—1
Ⅲ.已知常温时醋酸的电离常数为1.8×10-5,一水合氨的电离常数为1.8×10-5。在少量Mg(OH)2悬浊液中,滴加适量饱和NH4Cl溶液,固体溶解。对于固体的溶解。
甲同学认为在氢氧化镁悬浊液中存在下列平衡:
Mg(OH)2  Mg2+ +2OH-
Mg2+ +2OH-
加入NH4Cl溶液,由于NH4+水解产生H+中和了Mg(OH)2电离产生的OH-而使平衡右移导致Mg(OH)2 溶解。
而乙同学却认为NH4Cl电离产生的NH4+结合了OH-生成了弱电解质NH3·H2O,使c(OH-)减小,平衡右移而导致Mg(OH)2 溶解。设计方案评价甲乙两位同学的观点:
_____________________________________ ______________________________
_________________________________________________________________________
查看习题详情和答案>>
Ⅰ.下图为常见仪器的部分结构(有的仪器被放大)
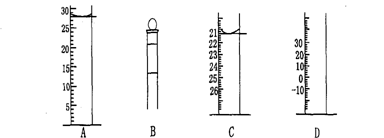
图A中液面所示溶液的体积为 mL,用上述四种仪器中的某种测量一液体的体积,平视时读数为n mL,仰视时读数为m mL,若m>n,则所使用的仪器是 (填字母标号)。
Ⅱ.某学生用标准0.25 mol·L—1 NaOH溶液滴定硫酸的实验操作如下:
A.用酸式滴定管取稀H2SO4 25.00 mL,注入锥形瓶中,加入指示剂。
B.用待测定的溶液润洗酸式滴定管。 C.用蒸馏水洗干净滴定管。
D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2~3 cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下。
E.检查滴定管是否漏水。 F.另取锥形瓶,再重复操作一次。
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
①滴定操作的正确顺序是(用序号填): 。
②该滴定操作中应选用的指示剂是: 。
③在G操作中如何确定终? 。
④碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果(填“偏小”、“偏大”或“恰好合适”) ,原因是 。
⑤假设操作均正确,标准液消耗了22.18mL,计算待测硫酸溶液的物质的量浓度(计算结果精确到小数点后二位) mol·L—1
Ⅲ.已知常温时醋酸的电离常数为1.8×10-5,一水合氨的电离常数为1.8×10-5。在少量Mg(OH)2悬浊液中,滴加适量饱和NH4Cl溶液,固体溶解。对于固体的溶解。
甲同学认为在氢氧化镁悬浊液中存在下列平衡:
Mg(OH)2 ![]() Mg2+ +2OH-
Mg2+ +2OH-
加入NH4Cl溶液,由于NH4+水解产生H+中和了Mg(OH)2电离产生的OH-而使平衡右移导致Mg(OH)2 溶解。
而乙同学却认为NH4Cl电离产生的NH4+结合了OH-生成了弱电解质NH3·H2O,使c(OH-)减小,平衡右移而导致Mg(OH)2 溶解。设计方案评价甲乙两位同学的观点:
_____________________________________ ______________________________
_________________________________________________________________________
查看习题详情和答案>>