网址:http://m.1010jiajiao.com/timu_id_356281[举报]
U、V、W、X、Y、Z属于周期表中前18号元素,原子序数依次增大。已知:
①WU4++XU-=WU3 + U2X,各种反应物和生成物的电子总数都与Y+相等;
②Z的单质在X2中燃烧的产物可使品红溶液褪色;
③V的单质在X2中燃烧可生成VX和VX2两种气体;
④Y的单质是一种金属,该金属与X2反应可生成Y2X和Y2X2两种固体。
请回答下列问题:
(1)WU3分子的空间构型为 Z元素在周期表中的位置是 。
(2)写出Y2X2与水反应的化学方程式: 。
(3)V、W、X形成的10电子氢化物中,沸点最高的是(写化学式) 。
(4)U2X2与FeSO4按物质的量之比1:2溶于稀硫酸中,反应的离子方程式为
。
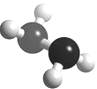
(5)已知下图的球棍模型所表示的是由U、W两种元素组成的共价化合物A, 则A的分子式为 A与氧气及氢氧化钾溶液还可构成燃料电池。正极的电极反应为:
(12分)实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量铁铝合金与100mL某浓度的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示(C>0)。试回答下列问题:

(1)写出反应过程中的离子反应方程式:
OC段 ,
DE段 ,
EF段___________________________________ __________。
(2)硝酸溶液的物质的量浓度为 mol·L-1
(3)B的值为_________mol,C的值为 mL。
【解析】由题意知,金属与硝酸反应时,硝酸的还原产物为NH4NO3,由图又可看出金属与硝酸反应后,硝酸是过量的,故金属的氧化产物为Fe(NO3)3、Al(NO3)3。图中:①O→C:H++OH-===H2O;②C→88:R3++3OH-===R(OH)3↓(R代表Fe或Al);③88→94:NH+OH-===NH3·H2O;④94→104:Al(OH)3+OH-===AlO+2H2O。由④知n[Al(OH)3]=0.01 L×4 mol·L-1=0.04 mol=n(Al)。由③知,n(NH4NO3)=0.006 L×4 mol·L-1=0.024 mol,根据反应中得失电子相等的原则得:3n(R3+)=0.024×8=0.192 mol,则n(R3+)=0.064 mol=n(合金),故混合物中n(Fe)=0.024mol。0→88 mL中,用于沉淀金属离子的OH-有0.064 mol×3=0.192 mol,故C点:(0.088 L×4 mol·L-1-0.192 mol)÷4 mol·L-1=0.04 L,即40 mL。据原子守恒可知硝酸的物质的量是0.094L×4mol/L=0.376mol。其浓度是3.76mol/L。
查看习题详情和答案>>
(12分)实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量铁铝合金与100mL某浓度的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示(C>0)。试回答下列问题:
(1)写出反应过程中的离子反应方程式:
OC段 ,
DE段 ,
EF段___________________________________ __________。
(2)硝酸溶液的物质的量浓度为 mol·L-1
(3)B的值为_________mol,C的值为 mL。
【解析】由题意知,金属与硝酸反应时,硝酸的还原产物为NH4NO3,由图又可看出金属与硝酸反应后,硝酸是过量的,故金属的氧化产物为Fe(NO3)3、Al(NO3)3。图中:①O→C:H++OH-===H2O;②C→88:R3++3OH-===R(OH)3↓(R代表Fe或Al);③88→94:NH+OH-===NH3·H2O;④94→104:Al(OH)3+OH-===AlO+2H2O。由④知n[Al(OH)3]=0.01 L×4 mol·L-1=0.04 mol=n(Al)。由③知,n(NH4NO3)=0.006 L×4 mol·L-1=0.024 mol,根据反应中得失电子相等的原则得:3n(R3+)=0.024×8=0.192 mol,则n(R3+)=0.064 mol=n(合金),故混合物中n(Fe)=0.024mol。0→88 mL中,用于沉淀金属离子的OH-有0.064 mol×3=0.192 mol,故C点:(0.088 L×4 mol·L-1-0.192 mol)÷4 mol·L-1=0.04 L,即40 mL。据原子守恒可知硝酸的物质的量是0.094L×4mol/L=0.376mol。其浓度是3.76mol/L。
查看习题详情和答案>>
(13分)下表为元素周期表中前四周期的部分元素(从左到右按原子序数递增排列,部分涉及到的元素未给出元素符号),根据要求回答下列各小题:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1)在以上表格中所有元素里基态原子的电子排布中4s轨道上只有1个电子的元素有 (填元素名称)。
(2)根据元素原子的外围电子排布的特征,可将元素周期表前四周期元素分成4个区域,分别为s区、p区、d区、ds区,,则属于s区的元素有 种,属于d区的元素有 种。第二周期元素中除Ne外电负性由高到低的三种元素依次是 ,电离能由高到低的三种元素依次是 。
(3)Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
|
元素 |
Mn |
Fe |
|
|
电离能 ( kJ·mol-1) |
I1 |
717 |
759 |
|
I2 |
1509 |
1561 |
|
|
I3 |
3248 |
2957 |
回答下列问题:
Mn元素的电子排布式为____________________________________,
Fe2+的电子排布图为__________________________
比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个 电子难。对此,你的解释是:_____________________________
【解析】(1)考查元素周期表的结构和原子核外电子的排布规律。根据构造原理可知4s轨道上只有1个电子的元素是K、Cr和 Cu。
(2)除ds区外,区的名称来自于构造原理最后填入电子的能级的符号,即s区包括第IA和ⅡA,共2列。p区包括第ⅢA到第 ⅦA以及0族,共6列。D区包括第3列到第10列,共8列。ds区包括第11和12列,共2列。非金属性越强,电负性越大,第一电离能也越大,非金属性是Cl>S>P,所以电负性是Cl>S>P。由于P原子的3p轨道属于半充满,属于第一电离能是Cl>P>S。
(3)根据构造原理可以写出锰元素的电子排布,即1s22s22p63s23p63d54s2,Fe2+的电子排布图为1s22s22p63s23p63d6。由于Mn2+的3d轨道属于半充满,比较稳定,所以再失去1个电子所需要的能量就高。而Fe2+的3d轨道上有6个电子,Fe3+的3d轨道上有5个电子,属于不充满比较稳定,因此3d能级由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少。
查看习题详情和答案>>
(13分)下表为元素周期表中前四周期的部分元素(从左到右按原子序数递增排列,部分涉及到的元素未给出元素符号),根据要求回答下列各小题:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1)在以上表格中所有元素里基态原子的电子排布中4s轨道上只有1个电子的元素有 (填元素名称)。
(2)根据元素原子的外围电子排布的特征,可将元素周期表前四周期元素分成4个区域,分别为s区、p区、d区、ds区,,则属于s区的元素有 种,属于d区的元素有 种。第二周期元素中除Ne外电负性由高到低的三种元素依次是 ,电离能由高到低的三种元素依次是 。
(3)Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
| 元素 | Mn | Fe | |
| 电离能 ( kJ·mol-1) | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 |
回答下列问题:
Mn元素的电子排布式为____________________________________,
Fe2+的电子排布图为__________________________
比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个 电子难。对此,你的解释是:_____________________________
【解析】(1)考查元素周期表的结构和原子核外电子的排布规律。根据构造原理可知4s轨道上只有1个电子的元素是K、Cr和 Cu。
(2)除ds区外,区的名称来自于构造原理最后填入电子的能级的符号,即s区包括第IA和ⅡA,共2列。p区包括第ⅢA到第 ⅦA以及0族,共6列。D区包括第3列到第10列,共8列。ds区包括第11和12列,共2列。非金属性越强,电负性越大,第一电离能也越大,非金属性是Cl>S>P,所以电负性是Cl>S>P。由于P原子的3p轨道属于半充满,属于第一电离能是Cl>P>S。
(3)根据构造原理可以写出锰元素的电子排布,即1s22s22p63s23p63d54s2,Fe2+的电子排布图为1s22s22p63s23p63d6。由于Mn2+的3d轨道属于半充满,比较稳定,所以再失去1个电子所需要的能量就高。而Fe2+的3d轨道上有6个电子,Fe3+的3d轨道上有5个电子,属于不充满比较稳定,因此3d能级由不稳定的3d6到稳定的3d5半充满状态,需要的能量相对要少。
查看习题详情和答案>>