题目内容
U、V、W、X、Y、Z属于周期表中前18号元素,原子序数依次增大。已知:
①WU4++XU-=WU3 + U2X,各种反应物和生成物的电子总数都与Y+相等;
②Z的单质在X2中燃烧的产物可使品红溶液褪色;
③V的单质在X2中燃烧可生成VX和VX2两种气体;
④Y的单质是一种金属,该金属与X2反应可生成Y2X和Y2X2两种固体。
请回答下列问题:
(1)WU3分子的空间构型为 Z元素在周期表中的位置是 。
(2)写出Y2X2与水反应的化学方程式: 。
(3)V、W、X形成的10电子氢化物中,沸点最高的是(写化学式) 。
(4)U2X2与FeSO4按物质的量之比1:2溶于稀硫酸中,反应的离子方程式为
。
(5)已知下图的球棍模型所表示的是由U、W两种元素组成的共价化合物A, 则A的分子式为 A与氧气及氢氧化钾溶液还可构成燃料电池。正极的电极反应为:
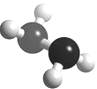
(1)三角锥形 3周期、ⅥA族
(2)2Na2O2+2H2O=4NaOH+O2↑
(3)H2O
(4)H2O2+2Fe2++2H+=2Fe3++2H2O
(5)N2H4 O2 +2H2O+4e-=4OH-

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案
相关题目



 有U、V、W、X、Y、Z、T七种前四周期元素,它们的原子序数依次增大,其相关信息如下表:
有U、V、W、X、Y、Z、T七种前四周期元素,它们的原子序数依次增大,其相关信息如下表: