网址:http://m.1010jiajiao.com/timu_id_344065[举报]
一、选择题(本题包括9小题,每小题3分,共27分。每小题只有一个选项符合题意。)
1.C 2.B 3.B 4.B 5.D 6.D 7.B 8.A 9.B
二、选择题(本题包括9小题,每小题4分,共36分。每小题有一个或两个选项符合题意。若正确答案包括两个选项,只选一个且正确得2分,但只要选错一个就得0分)
10.C 11.C 12.BC 13.D 14.AC 15.AD 16.AB 17.D 18.BD
三、(本题包括3小题,共32分)
19.(10分)
(1)①-----化学.files/image569.gif) [或
[或-----化学.files/image569.gif) 和
和-----化学.files/image572.gif) ](2分)
](2分)
②将-----化学.files/image574.gif) 晶体在干燥的
晶体在干燥的-----化学.files/image194.gif) 气流中加热(1分)
气流中加热(1分)
②关闭-----化学.files/image579.gif) ,打开
,打开-----化学.files/image581.gif) ,通入足量空气后,再打开
,通入足量空气后,再打开-----化学.files/image579.gif) ,关闭
,关闭-----化学.files/image581.gif) (2分)
(2分)
③D中碱石灰会吸收空气中水蒸气和-----化学.files/image078.gif) 等酸性气体,产生误差,测得
等酸性气体,产生误差,测得-----化学.files/image585.gif) 偏大,
偏大,-----化学.files/image587.gif) 偏小(2分)
偏小(2分)
④-----化学.files/image589.gif) (2分)
(2分)
20.(12分)
(2) -----化学.files/image096.gif) (1分) (3)②③(2分)
(1分) (3)②③(2分)
(5)①-----化学.files/image592.gif) (1分)
(1分)
-----化学.files/image594.gif) (血红色)(1分)
(血红色)(1分)
②-----化学.files/image279.gif) 氧化
氧化-----化学.files/image351.gif) ,使平衡
,使平衡-----化学.files/image598.gif)
-----化学.files/image306.gif)
-----化学.files/image600.gif) 左移,红色消失(2分)
左移,红色消失(2分)
③取一支试管,加入少量-----化学.files/image602.gif) 溶液和几滴
溶液和几滴-----化学.files/image604.gif) 溶液,溶液变为红色,再加入适量
溶液,溶液变为红色,再加入适量-----化学.files/image279.gif) 振荡,产生气泡,红色褪去,说明是
振荡,产生气泡,红色褪去,说明是-----化学.files/image279.gif) 氧化了溶液的
氧化了溶液的-----化学.files/image351.gif) 离子使溶液褪色(2分)
离子使溶液褪色(2分)
说明:(1)加入-----化学.files/image279.gif) 与
与-----化学.files/image604.gif) 溶液的顺序可以互换;(2)上面离子方程式的
溶液的顺序可以互换;(2)上面离子方程式的-----化学.files/image351.gif) 写成
写成-----化学.files/image604.gif) 不扣分;(3)简答中要有仪器、试剂、操作、现象、结论共5个要点,现象“产生气泡”和“红色褪去”2点不能少;(4)若把“溶液褪色”答成“溶液变为黄色或棕色”照样给分。
不扣分;(3)简答中要有仪器、试剂、操作、现象、结论共5个要点,现象“产生气泡”和“红色褪去”2点不能少;(4)若把“溶液褪色”答成“溶液变为黄色或棕色”照样给分。
(6)第六步:还原性(1分) -----化学.files/image096.gif) 在人体血红蛋白中起传送
在人体血红蛋白中起传送-----化学.files/image300.gif) 的作用,
的作用,-----化学.files/image357.gif) 没有此功能,服用
没有此功能,服用-----化学.files/image611.gif) 可防止药品的
可防止药品的-----化学.files/image096.gif) 氧化成
氧化成-----化学.files/image357.gif) (或答成人体只能吸收
(或答成人体只能吸收-----化学.files/image096.gif) ,
,-----化学.files/image096.gif) 在人体血红蛋白中起传送
在人体血红蛋白中起传送-----化学.files/image300.gif) 的作用,服用
的作用,服用-----化学.files/image611.gif) 可防止药品的
可防止药品的-----化学.files/image096.gif) 氧化成
氧化成-----化学.files/image357.gif) )(2分)
)(2分)
21.(10分)
(1) -----化学.files/image046.gif) 、
、-----化学.files/image362.gif) (2)
(2) -----化学.files/image046.gif) 、
、-----化学.files/image364.gif) (3)
(3) -----化学.files/image364.gif) 、
、-----化学.files/image362.gif) (每空1分,全对4分,可以互换)
(每空1分,全对4分,可以互换)
(5) -----化学.files/image368.gif) (1分)
(1分) -----化学.files/image572.gif) (1分)
(1分)
(6) -----化学.files/image618.gif)
-----化学.files/image620.gif) (2分)
(2分)
(7)将沉淀A、F洗涤,小心干燥,分别称量(2分)
四、(本题包括3小题,共37分)
22.(共10分)
(1) -----化学.files/image622.gif) (2分)
(2分)
(2) -----化学.files/image624.gif) 、
、-----化学.files/image078.gif) (2分); 不需要(1分)
(2分); 不需要(1分)
(3)22% (2分)
(4) -----化学.files/image627.gif) (1分); 450(2分)
(1分); 450(2分)
23.(15分) w.w.w.k.s.5.u.c.o.m
(1) -----化学.files/image629.gif) (2分)
(2分)
(2)乙(1分) 流程乙中原料-----化学.files/image423.gif) 来源丰富,价格低,工艺流程简单、技术成熟。(2分)
来源丰富,价格低,工艺流程简单、技术成熟。(2分)
(3)①AD(2分)
②经蒸发、浓缩、冷却至
③-----化学.files/image632.gif) (1分) 取出少许滤液置于试管,加稀盐酸至溶液呈酸性后,过滤得出
(1分) 取出少许滤液置于试管,加稀盐酸至溶液呈酸性后,过滤得出-----化学.files/image042.gif) ,再往滤液中加
,再往滤液中加-----化学.files/image106.gif) 溶液,如有白色沉淀即可证明含有
溶液,如有白色沉淀即可证明含有-----化学.files/image632.gif) (2分)
(2分)
④解:若该反应完全得到-----化学.files/image426.gif) :
:
-----化学.files/image638.gif) (1分)
(1分)
若蒸发浓缩得到的-----化学.files/image440.gif) 溶液为饱和溶液,其所含的
溶液为饱和溶液,其所含的-----化学.files/image426.gif) :
:
-----化学.files/image641.gif) (1分)
(1分)
-----化学.files/image643.gif) ,则该溶液尚未饱和,
,则该溶液尚未饱和,
-----化学.files/image645.jpg) 24.(11分)
24.(11分)
(1) -----化学.files/image647.gif) (2分)
(2分)
(2)0.75(2分)
(3)①c;(1分)②参看右图(2分)
(4) -----化学.files/image649.gif) (2分)
(2分)
(5)B、D(2分)
五、(本题包括1小题,9分) w.w.w.k.s.5.u.c.o.m
25.(9分)
(1)AD(2分)
(2)Ⅰ.甲酸钠;氧化反应,取代反应。(3分)
Ⅱ.反应②:-----化学.files/image651.jpg) (2分)
(2分)
反应⑥:-----化学.files/image653.jpg) (2分)
(2分)
六、选做题(本题包括2小题,每小题10分。考生只能选做一题。26小题为“有机化学基础”内容的试题,27小题为“物质结构与性质”内容的试题)
26.(10分)答:
(1)①液体分为两层,上层液体无色,下层液体仍是红棕色;②溴水褪色,产生白色浑浊;③活泼。(每空1分,共3分)
(2)Ⅰ.-----化学.files/image655.gif) (1分)
(1分)
Ⅱ.-----化学.files/image657.jpg) (2分)
(2分)
(3) Ⅰ.-----化学.files/image659.jpg) (2分)
(2分)
Ⅱ.先将-----化学.files/image498.gif) 保护起来,防止酚羟基被
保护起来,防止酚羟基被-----化学.files/image662.gif) 氧化,通过反应⑥再重新生成酚羟基。(1分)
氧化,通过反应⑥再重新生成酚羟基。(1分)
Ⅲ.-----化学.files/image664.gif) 过量,使化学平衡向正反应方向移动;或边反应边蒸馏降低
过量,使化学平衡向正反应方向移动;或边反应边蒸馏降低-----化学.files/image666.gif) 的浓度,使化学平衡向正反应方向移动。(1分)
的浓度,使化学平衡向正反应方向移动。(1分)
27.(10分)
(1) -----化学.files/image668.gif) (1分)
(1分)
(2) -----化学.files/image235.gif) 分子结构为
分子结构为-----化学.files/image671.gif) ,键能大,难断裂生成氮的化合物
,键能大,难断裂生成氮的化合物
-----化学.files/image076.gif) 分子结构为
分子结构为-----化学.files/image674.gif) ,键能小,易断裂生成氯的化合物 (2分)
,键能小,易断裂生成氯的化合物 (2分)
(3) -----化学.files/image519.gif) 分子中的
分子中的-----化学.files/image006.gif) 原子采取
原子采取-----化学.files/image678.gif) 杂化,
杂化,-----化学.files/image537.gif) 分子中的
分子中的-----化学.files/image006.gif) 原子采取
原子采取-----化学.files/image681.gif) 杂化(2分),D(1分)
杂化(2分),D(1分)
(4)6(1分);①离子晶体的晶格能愈大,晶体熔点愈高 ②晶体中离子电荷数愈大,晶格能愈大,熔点愈高 ③晶体中离子间距离愈小,晶格能愈大,熔点愈高(2分,答对2条即可)
(5) -----化学.files/image683.gif) (1分)
(1分)
A.原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物种最多的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29。
回答下列问题:
(1) 分子中Y原子轨道的杂化类型为
,1mol
分子中Y原子轨道的杂化类型为
,1mol 含有
含有 键的数目为 。
键的数目为 。
(2)化合物 的沸点比化合物
的沸点比化合物 的高,其主要原因是
。
的高,其主要原因是
。
(3)元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是 。
(4)元素W的一种氯化物晶体的晶胞结构如图13所示,该氯化物的化学式是
,它可与浓盐酸发生非氧化还原反应,生成配合物 ,反应的化学方程式为
。
,反应的化学方程式为
。

B.草酸是一种重要的化工产品。实验室用硝酸氧化淀粉水解液制备草酸的装置如图14所示(加热、搅拌和仪器固定装置均已略去)

实验过程如下:
①将一定量的淀粉水解液加入三颈瓶中
②控制反应液温度在55~60℃条件下,边搅拌边缓慢滴加一定量含有适量催化剂的混酸(65%HNO3与98%H2SO4的质量比为2:1.5)溶液
③反应3h左右,冷却,抽滤后再重结晶得草酸晶体。
硝酸氧化淀粉水解液过程中可发生下列反应:
C6H12O6+12HNO3 →3H2C2O4+9NO2↑ +3NO↑ +9H2O
C6H12O6+8HNO3 →6CO2+8NO↑ +10H2O
3H2C2O4+2HNO3 →6CO2+2NO↑ +4H2O
(1)检验淀粉是否水解完全所需用的试剂为
(2)实验中若混酸滴加过快,将导致草酸产率下降,其原因是
(3)装置C用于尾气吸收,当尾气中n(NO2):n(NO)=1:1时,过量的NaOH溶液能将NO,全部吸收,原因是 (用化学方程式表示)
(4)与用NaOH溶液吸收尾气相比较,若用淀粉水解液吸收尾气,其优、缺点是 。
(5)草酸重结晶的减压过滤操作中,除烧杯、玻璃棒外,还必须使用属于硅酸盐材料的仪器有 。
查看习题详情和答案>>
(1) CaC2中C22-与O22+互为等电子体,O22+的电子式可表示为____; 1 mol O22+中含有的π键数目为____。
(2)将乙炔通入[ Cu( NH3)2]Cl溶液生成Cu2C2红棕色沉淀。Cu+基态核外电子排布式为____。
(3)乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C三N)。丙烯腈分子中碳原子轨道杂化类型是____;分子中处于同一直线上的原子数目最多为____
(4)CaC2晶体的晶胞结构与NaCl晶体的相似(如下图所示),但CaC2晶体中哑铃形C22-的存在,使晶胞沿一个方向拉长。CaC2晶体中1个Ca2+周围距离最近的C22- 数目为____。
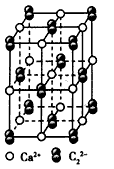
(5)上述实验中过滤的目的是____。
(6)滤液在分液漏斗中洗涤静置后,有机层处于___层(填“上”或“下”); 放液时,若发现液体流不下来,其可能原因除分液漏斗活塞堵塞外,还有_______________
(7)下表给出了催化剂种类及用量对甲苯硝化反应影响的实验结果。
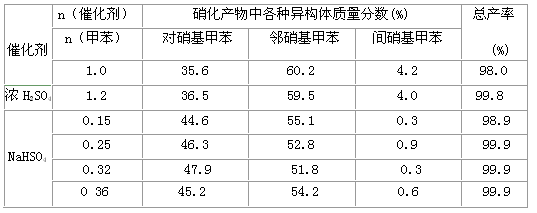
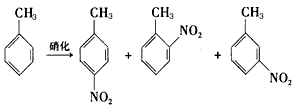
②由甲苯硝化得到的各种产物的含量可知,甲苯硝化反应的特点是_______
③与浓硫酸催化甲苯硝化相比,NaHSO4催化甲苯硝化的优点有______、______
A.B.C.D.E为含同一种元素的常见物质.C物质只由一种元素组成,在1个C分子中形成共价键的电子数与分子中所含电子数之比为3∶7.C和E均可与氧气在一定条件下反应生成A.请回答以下问题:
(1)常温下将气体B通入水中发生反应,生成A和D,则该反应的离子方程式________.
(2)写出E与氧气反应生成A的化学方程式________.
(3)D和E生成的化合物在某温度下加热分解,同时生成两种氧化物.且在此过程中,若有0.5 mol该化合物完全反应,转移电子数为2 mol.写出该反应的化学方程式________.
(4)下图所示是进行木炭与D浓溶液反应,并检验生成的气体和反应的热效应的实验装置,它具有无污染.现象明显等特点.具支试管A中所盛固体下层是无水CaCl2(作载体不参加反应),上层是红热的木炭.实验时慢慢将D浓溶液滴到木炭上,反应即开始进行且能长时间剧烈反应.
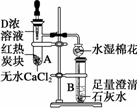
①写出木炭与D浓溶液反应的化学方程式________.
②该反应为________(填“吸热”或“放热”)反应.
③试管B内出现的现象为________.
④在实验临近结束时,发现滴管中的D浓溶液难以滴下.若想再滴入几滴D浓溶液使木炭反应完全,最简单的办法是________.
| A | C | |
| B |
(2)A、B、C、D、E的单质中,氧化性最强的化学式为
(3)A的氢化物溶于水呈
(4)写出D和E的最高价氧化物对应的水化物二者反应的离子方程式
(1)A可以发生的反应有
①加成反应 ②酯化反应 ③加聚反应 ④氧化反应
(2)B分子所含官能团的名称是
(3)与B具有相同官能团的同分异构体的结构简式(包括B)是
(4)由B制取A的化学方程式是:


-----化学.files/image577.jpg)