网址:http://m.1010jiajiao.com/timu_id_343922[举报]
一、选择题(本题包括9小题,每小题3分,共27分。每小题只有一个选项符合题意。)
1.C 2.B 3.B 4.B 5.D 6.D 7.B 8.A 9.B
二、选择题(本题包括9小题,每小题4分,共36分。每小题有一个或两个选项符合题意。若正确答案包括两个选项,只选一个且正确得2分,但只要选错一个就得0分)
10.C 11.C 12.BC 13.D 14.AC 15.AD 16.AB 17.D 18.BD
三、(本题包括3小题,共32分)
19.(10分)
(1)①-----化学.files/image569.gif) [或
[或-----化学.files/image569.gif) 和
和-----化学.files/image572.gif) ](2分)
](2分)
②将-----化学.files/image574.gif) 晶体在干燥的
晶体在干燥的-----化学.files/image194.gif) 气流中加热(1分)
气流中加热(1分)
②关闭-----化学.files/image579.gif) ,打开
,打开-----化学.files/image581.gif) ,通入足量空气后,再打开
,通入足量空气后,再打开-----化学.files/image579.gif) ,关闭
,关闭-----化学.files/image581.gif) (2分)
(2分)
③D中碱石灰会吸收空气中水蒸气和-----化学.files/image078.gif) 等酸性气体,产生误差,测得
等酸性气体,产生误差,测得-----化学.files/image585.gif) 偏大,
偏大,-----化学.files/image587.gif) 偏小(2分)
偏小(2分)
④-----化学.files/image589.gif) (2分)
(2分)
20.(12分)
(2) -----化学.files/image096.gif) (1分) (3)②③(2分)
(1分) (3)②③(2分)
(5)①-----化学.files/image592.gif) (1分)
(1分)
-----化学.files/image594.gif) (血红色)(1分)
(血红色)(1分)
②-----化学.files/image279.gif) 氧化
氧化-----化学.files/image351.gif) ,使平衡
,使平衡-----化学.files/image598.gif)
-----化学.files/image306.gif)
-----化学.files/image600.gif) 左移,红色消失(2分)
左移,红色消失(2分)
③取一支试管,加入少量-----化学.files/image602.gif) 溶液和几滴
溶液和几滴-----化学.files/image604.gif) 溶液,溶液变为红色,再加入适量
溶液,溶液变为红色,再加入适量-----化学.files/image279.gif) 振荡,产生气泡,红色褪去,说明是
振荡,产生气泡,红色褪去,说明是-----化学.files/image279.gif) 氧化了溶液的
氧化了溶液的-----化学.files/image351.gif) 离子使溶液褪色(2分)
离子使溶液褪色(2分)
说明:(1)加入-----化学.files/image279.gif) 与
与-----化学.files/image604.gif) 溶液的顺序可以互换;(2)上面离子方程式的
溶液的顺序可以互换;(2)上面离子方程式的-----化学.files/image351.gif) 写成
写成-----化学.files/image604.gif) 不扣分;(3)简答中要有仪器、试剂、操作、现象、结论共5个要点,现象“产生气泡”和“红色褪去”2点不能少;(4)若把“溶液褪色”答成“溶液变为黄色或棕色”照样给分。
不扣分;(3)简答中要有仪器、试剂、操作、现象、结论共5个要点,现象“产生气泡”和“红色褪去”2点不能少;(4)若把“溶液褪色”答成“溶液变为黄色或棕色”照样给分。
(6)第六步:还原性(1分) -----化学.files/image096.gif) 在人体血红蛋白中起传送
在人体血红蛋白中起传送-----化学.files/image300.gif) 的作用,
的作用,-----化学.files/image357.gif) 没有此功能,服用
没有此功能,服用-----化学.files/image611.gif) 可防止药品的
可防止药品的-----化学.files/image096.gif) 氧化成
氧化成-----化学.files/image357.gif) (或答成人体只能吸收
(或答成人体只能吸收-----化学.files/image096.gif) ,
,-----化学.files/image096.gif) 在人体血红蛋白中起传送
在人体血红蛋白中起传送-----化学.files/image300.gif) 的作用,服用
的作用,服用-----化学.files/image611.gif) 可防止药品的
可防止药品的-----化学.files/image096.gif) 氧化成
氧化成-----化学.files/image357.gif) )(2分)
)(2分)
21.(10分)
(1) -----化学.files/image046.gif) 、
、-----化学.files/image362.gif) (2)
(2) -----化学.files/image046.gif) 、
、-----化学.files/image364.gif) (3)
(3) -----化学.files/image364.gif) 、
、-----化学.files/image362.gif) (每空1分,全对4分,可以互换)
(每空1分,全对4分,可以互换)
(5) -----化学.files/image368.gif) (1分)
(1分) -----化学.files/image572.gif) (1分)
(1分)
(6) -----化学.files/image618.gif)
-----化学.files/image620.gif) (2分)
(2分)
(7)将沉淀A、F洗涤,小心干燥,分别称量(2分)
四、(本题包括3小题,共37分)
22.(共10分)
(1) -----化学.files/image622.gif) (2分)
(2分)
(2) -----化学.files/image624.gif) 、
、-----化学.files/image078.gif) (2分); 不需要(1分)
(2分); 不需要(1分)
(3)22% (2分)
(4) -----化学.files/image627.gif) (1分); 450(2分)
(1分); 450(2分)
23.(15分) w.w.w.k.s.5.u.c.o.m
(1) -----化学.files/image629.gif) (2分)
(2分)
(2)乙(1分) 流程乙中原料-----化学.files/image423.gif) 来源丰富,价格低,工艺流程简单、技术成熟。(2分)
来源丰富,价格低,工艺流程简单、技术成熟。(2分)
(3)①AD(2分)
②经蒸发、浓缩、冷却至
③-----化学.files/image632.gif) (1分) 取出少许滤液置于试管,加稀盐酸至溶液呈酸性后,过滤得出
(1分) 取出少许滤液置于试管,加稀盐酸至溶液呈酸性后,过滤得出-----化学.files/image042.gif) ,再往滤液中加
,再往滤液中加-----化学.files/image106.gif) 溶液,如有白色沉淀即可证明含有
溶液,如有白色沉淀即可证明含有-----化学.files/image632.gif) (2分)
(2分)
④解:若该反应完全得到-----化学.files/image426.gif) :
:
-----化学.files/image638.gif) (1分)
(1分)
若蒸发浓缩得到的-----化学.files/image440.gif) 溶液为饱和溶液,其所含的
溶液为饱和溶液,其所含的-----化学.files/image426.gif) :
:
-----化学.files/image641.gif) (1分)
(1分)
-----化学.files/image643.gif) ,则该溶液尚未饱和,
,则该溶液尚未饱和,
-----化学.files/image645.jpg) 24.(11分)
24.(11分)
(1) -----化学.files/image647.gif) (2分)
(2分)
(2)0.75(2分)
(3)①c;(1分)②参看右图(2分)
(4) -----化学.files/image649.gif) (2分)
(2分)
(5)B、D(2分)
五、(本题包括1小题,9分) w.w.w.k.s.5.u.c.o.m
25.(9分)
(1)AD(2分)
(2)Ⅰ.甲酸钠;氧化反应,取代反应。(3分)
Ⅱ.反应②:-----化学.files/image651.jpg) (2分)
(2分)
反应⑥:-----化学.files/image653.jpg) (2分)
(2分)
六、选做题(本题包括2小题,每小题10分。考生只能选做一题。26小题为“有机化学基础”内容的试题,27小题为“物质结构与性质”内容的试题)
26.(10分)答:
(1)①液体分为两层,上层液体无色,下层液体仍是红棕色;②溴水褪色,产生白色浑浊;③活泼。(每空1分,共3分)
(2)Ⅰ.-----化学.files/image655.gif) (1分)
(1分)
Ⅱ.-----化学.files/image657.jpg) (2分)
(2分)
(3) Ⅰ.-----化学.files/image659.jpg) (2分)
(2分)
Ⅱ.先将-----化学.files/image498.gif) 保护起来,防止酚羟基被
保护起来,防止酚羟基被-----化学.files/image662.gif) 氧化,通过反应⑥再重新生成酚羟基。(1分)
氧化,通过反应⑥再重新生成酚羟基。(1分)
Ⅲ.-----化学.files/image664.gif) 过量,使化学平衡向正反应方向移动;或边反应边蒸馏降低
过量,使化学平衡向正反应方向移动;或边反应边蒸馏降低-----化学.files/image666.gif) 的浓度,使化学平衡向正反应方向移动。(1分)
的浓度,使化学平衡向正反应方向移动。(1分)
27.(10分)
(1) -----化学.files/image668.gif) (1分)
(1分)
(2) -----化学.files/image235.gif) 分子结构为
分子结构为-----化学.files/image671.gif) ,键能大,难断裂生成氮的化合物
,键能大,难断裂生成氮的化合物
-----化学.files/image076.gif) 分子结构为
分子结构为-----化学.files/image674.gif) ,键能小,易断裂生成氯的化合物 (2分)
,键能小,易断裂生成氯的化合物 (2分)
(3) -----化学.files/image519.gif) 分子中的
分子中的-----化学.files/image006.gif) 原子采取
原子采取-----化学.files/image678.gif) 杂化,
杂化,-----化学.files/image537.gif) 分子中的
分子中的-----化学.files/image006.gif) 原子采取
原子采取-----化学.files/image681.gif) 杂化(2分),D(1分)
杂化(2分),D(1分)
(4)6(1分);①离子晶体的晶格能愈大,晶体熔点愈高 ②晶体中离子电荷数愈大,晶格能愈大,熔点愈高 ③晶体中离子间距离愈小,晶格能愈大,熔点愈高(2分,答对2条即可)
(5) -----化学.files/image683.gif) (1分)
(1分)
①用pH试纸测溶液的PH,试纸显红色;
②取2毫升溶液,用氯化钡和稀硝酸进行检验,结果生成了白色沉淀;
③对②中所得混合物充分静置后,取上层清夜用硝酸银溶液和稀硝酸检验,结果又生成了白色沉淀,
试回答下述问题:
(1)原溶液中一定存在的离子是___________,一定不存在的离子是___________。
(2)上述实验操作中,有错误的步骤是(填写代号)___________,对错误的改正方法是___________。
(3)按改正后的操作,还不能肯定是否存在的离子是___________。
今有一澄清溶液,只可能含有①阳离子:K+、NH4+、H+、Ba2+ ②阴离子:Cl-、CO32-、SO42-、OH-中的若干种离子(存在的离子均大量),现取三份上述澄清溶液各100mL,分别进行以下实验:
①第一份加入AgNO3溶液有沉淀产生;
②第二份加入足量NaOH溶液加热后,收集到0.04mol气体
③第三份加足量BaCl2溶液后,得干燥沉淀6.27g。经足量盐酸洗涤后,干燥得沉淀2.33g。
请回答下列问题:
(1) 100mL溶液中C(SO42-)=
(2)加入NaOH溶液产生气体的离子方程式:
(3) 6.27g沉淀所含有的成分是(填化学式)
(4)上述澄清溶液中除SO42-以外,一定还大量共存的离子是
查看习题详情和答案>>(15分)
水是生命之源,万物之基,是人类最宝贵的自然资源
(1)我国规定水质各种指标的主要要求为:a.不得呈现异色:b.不得有异味:C.水应澄清透明:d.不得含有细菌和病毒。前两项指标可以利用活性炭的____作用来实现:后两项指标可以通过加入消毒剂、絮凝剂反应、沉降,然后通过_____(填操作名称)来实现
(2)我国规定饮用水的硬度不超过25度硬度的表示方法是:将水中的 都看作
都看作 ,并将其质量折算成CaO的质量,通常把1 L水中含有10 mg CaO称为10,水中的
,并将其质量折算成CaO的质量,通常把1 L水中含有10 mg CaO称为10,水中的 和Mg2+可用一定浓度的Y溶液进行滴定,Y跟
和Mg2+可用一定浓度的Y溶液进行滴定,Y跟 都以等物质的量完全反应。现取某地区的地下水样品25.00 mL,用0.01000 mol/L的Y溶液滴定,完全反应时消耗Y溶液15.00 mLa该地下水的硬度为____,由此判断该地下水___(填“符合”或“不符合”饮用水标准
都以等物质的量完全反应。现取某地区的地下水样品25.00 mL,用0.01000 mol/L的Y溶液滴定,完全反应时消耗Y溶液15.00 mLa该地下水的硬度为____,由此判断该地下水___(填“符合”或“不符合”饮用水标准
(3)某地下水的硬度是由Ca(HC03)2所引起的,下列方法中能够使之软化的是_____
A.将水加热煮沸 B.加入适量的Na3P04
C.加入过量的稀盐酸 D.将水通过磺化煤
(4)工业上采用硫化钠一石灰铁盐法除去含砷废水(砷的主要存在形式为H3ASO3的主要工艺
流程如下
已知:a.亚砷酸(H3As03)还原性较强,易被氧化为砷酸(H3AsO3)
B.亚砷酸盐的溶解性大于相应的砷酸盐
请回答以下问题:
①废气的主要成分为____
②写出一级沉砷过程中生成雌黄的离子方程式:______
③滤渣B的主要成分有_____〔写两种,用化学式表示)
水是生命之源,万物之基,是人类最宝贵的自然资源
(1)我国规定水质各种指标的主要要求为:a.不得呈现异色:b.不得有异味:C.水应澄清透明:d.不得含有细菌和病毒。前两项指标可以利用活性炭的____作用来实现:后两项指标可以通过加入消毒剂、絮凝剂反应、沉降,然后通过_____(填操作名称)来实现
(2)我国规定饮用水的硬度不超过25度硬度的表示方法是:将水中的
 都看作
都看作 ,并将其质量折算成CaO的质量,通常把1 L水中含有10 mg CaO称为10,水中的
,并将其质量折算成CaO的质量,通常把1 L水中含有10 mg CaO称为10,水中的 和Mg2+可用一定浓度的Y溶液进行滴定,Y跟
和Mg2+可用一定浓度的Y溶液进行滴定,Y跟 都以等物质的量完全反应。现取某地区的地下水样品25.00 mL,用0.01000 mol/L的Y溶液滴定,完全反应时消耗Y溶液15.00 mLa该地下水的硬度为____,由此判断该地下水___(填“符合”或“不符合”饮用水标准
都以等物质的量完全反应。现取某地区的地下水样品25.00 mL,用0.01000 mol/L的Y溶液滴定,完全反应时消耗Y溶液15.00 mLa该地下水的硬度为____,由此判断该地下水___(填“符合”或“不符合”饮用水标准(3)某地下水的硬度是由Ca(HC03)2所引起的,下列方法中能够使之软化的是_____
A.将水加热煮沸 B.加入适量的Na3P04
C.加入过量的稀盐酸 D.将水通过磺化煤
(4)工业上采用硫化钠一石灰铁盐法除去含砷废水(砷的主要存在形式为H3ASO3的主要工艺
流程如下

已知:a.亚砷酸(H3As03)还原性较强,易被氧化为砷酸(H3AsO3)
B.亚砷酸盐的溶解性大于相应的砷酸盐
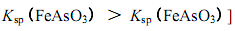
请回答以下问题:
①废气的主要成分为____
②写出一级沉砷过程中生成雌黄的离子方程式:______
③滤渣B的主要成分有_____〔写两种,用化学式表示)
对一份稀溶液作初步分析发现,溶液无色、澄清,其中可能含有SO![]() 、Na+、CO
、Na+、CO![]() 、H+、NO
、H+、NO![]() 、HCO
、HCO![]() 、Cl-等离子中的若干种.然后又做了如下实验,以确认这些离子是否大量存在.
、Cl-等离子中的若干种.然后又做了如下实验,以确认这些离子是否大量存在.
①用石蕊试纸测溶液的酸碱性,试纸显红色;
②取2毫升溶液,用氯化钡和稀硝酸进行检验,结果生成了白色沉淀;
③对(2)中所得混合物静置后,取上层清夜用硝酸银溶液和稀硝酸检验,结果又生成了白色沉淀,试回答下述问题:
(1)原溶液中一定存在的离子是________,一定不存在的离子是________.
(2)上述实验操作中,有错误的步骤是(填写代号)________,对错误的改正方法是________.
(3)按改正操作后实验,还不能肯定是否存在的离子是________.
(4)写出②、③步反应的离子方程式.
②________;③________;
-----化学.files/image577.jpg)