网址:http://m.1010jiajiao.com/timu_id_322944[举报]
第Ⅰ卷(选择题)
一、选择题(每题6分,共78分)
1.C 2.A 3.D 4.B 5.D
6.C 7.D 8.C 9.D 10.B 11.B 12.C 13.A
二、选择题(本题包括8小题。在每小题给出的四个选项中,有的只有一个选项正确,有的有多个选项正确,全部选对的得6分,选对但不全的得3分,有选错的得0分)
14.D 15.C 16.A 17.D 18.B 19.AD 20.C 21.AC
第Ⅱ卷(非选择题)
三、非选择题(本题共10小题)
22.⑴球1和球2的质量m1和m2,立柱的高h,桌面离地面的高H (3分)
m1 =m1
=m1 +m
+m (3分)
(3分)
⑵①电路图如图。(6分) ②实物图略 (5分)

23.解:⑴依题意得甲乙两同学的奔跑加速度相同,设为a,达到的最大速度为vm,由 得:
得: ① (2分)
① (2分)
设乙全力奔跑的距离为s1时,速度达到奔跑最大速度的80%,有:
 ② (2分)
② (2分)
联立①②解得:s1=
⑵设乙应在距离甲为s0时起跑,从此时开始到接棒所用的时间为t,在t内甲、乙的位移关系是: ④ (4分)
④ (4分)
而: ⑤ (1分)
⑤ (1分)  ⑥ (1分)
⑥ (1分)
 ⑦ (1分)
⑦ (1分)
联立③④⑤⑥⑦解得: m (2分)
m (2分)
24.解:⑴子弹进入小车的过程中,子弹与小车组成的系统动量守恒,由动量守恒定律得:
m1v0=(m2+m1)v1 ① (3分)
由三物体组成的系统动量守恒,由动量守恒定律得:
(m2+m1)v1=(m2+m1+m3)v2 ② (3分)
设小车最小长度为L,三物体相对静止后,对系统利用能量守恒定律得:
 (m2+m1)v12-
(m2+m1)v12- (m2+m1+m3)v22=μm3gL ③ (6分)
(m2+m1+m3)v22=μm3gL ③ (6分)
联立以上方程解得:L=
车与物体的共同速度为:v2= m/s) (2分)
m/s) (2分)
⑵以m3为研究对象,利用动量定理可得:μm3gt=m3v2 ④(4分)
解得:t=0.52s(或 s)
(2分)
s)
(2分)
25.解:⑴正电荷 (4分)
⑵依题意可知小球在BC间做匀速直线运动。
 在C点的速度为:
在C点的速度为: (2分)
(2分)
在BC段其受力如图所示,设重力和电场力合
力为F。
F=qvCB (1分)
又 F=mg/cos37°=5N(1分)
解得: (1分)
(1分)
在D处由牛顿第二定律可得:
 (2分)
(2分)
将 代入上式并化简得:
代入上式并化简得:
 解得
解得  (1分)
(1分)
小球离开D点后作类平抛运动,其加速度为:a=F/m (1分)
由 得:
得: (1分)
(1分)
 (1分)
(1分)
⑶CD段克服摩擦力做功Wf
由动能定理可得: (3分)
(3分)
解得:Wf=27.6J (2分)
26.(14分)
⑴C:
 (2分) B:第三周期,第IIIA族(2分)
(2分) B:第三周期,第IIIA族(2分)
⑵
 (2分)
(2分)
⑶2Al+2OH-+2H2O=2AlO2-+3H2↑(2分)
⑷Fe-2e-=Fe2+(2分),4Fe2++10H2O+O2=4Fe(OH)3↓+8H+(2分)
⑸FeO(2分)
27.(16分)
⑴(NH4)2SO3(1分) 
 (1分)
(1分)
⑵(NH4)2SO3+2NaOH
 Na2SO3+2NH3↑+2H2O(3分)
Na2SO3+2NH3↑+2H2O(3分)
Na2SO3+H2SO4=Na2SO4+SO2↑+H2O(3分)
⑶c(NH4+)>c(NO3-)>c(OH-)>c(H+)(2分)
⑷①90%(3分)
②0.4+0.1w(3分)
28.(17分)
⑴①d步骤中在点燃H2前没有先验纯。(2分)
②可能的原因是:一是分液漏斗的活塞没有打开,二是量气管中液面高于分液漏斗中液面。(4分)
⑵①A、B、E(3分,错选一个倒扣1分)
②A、B、C、D(3分,错选一个倒扣1分)
⑶①保持装置A和装置B液面相平(2分)
②CH2OHCH2OH(3分)
29.(13分)
⑴
 (3分)
(3分)
⑵不合理,因为酚羟基更容易被氧化(3分)
⑶
 (3分)
(3分)
 ⑷(各2分,共4分)
⑷(各2分,共4分)
30.(22分)
Ⅰ.(12分,每空2分)
⑴通入空气 培养液、老叶(缺一不得分) K
⑵下降 上升
⑶C3(或三碳化合物)
Ⅱ.(10分)
⑴抗原 体液 免疫细胞(说明:答体液免疫、细胞免疫亦可,顺序不能颠倒)(每空1分)
⑵病毒是专性活细胞内寄生(或病毒不能独立繁殖)(1分)
⑶①A:蛋白质与双缩脲试剂反应显紫色(或蛋白质液在碱性条件下与Cu2+反应显紫色)(2分)
B:DNA液与二苯胺试剂共热显蓝色(2分)
②酶处理(或水解法)(2分)
31.(每空2分,共20分)
⑴4、aaBb、矮生红果∶矮生黄果=3∶1
⑵13或11(只答13或只答11不得分) 正常或矮生(只答正常或只答矮生不得分)
⑶Y Y突变体的蛋白质氨基酸的改变比X突变体可能更多(X突变的蛋白质可能只有一个氨基酸发生变化,Y突变的蛋白质氨基酸序列可能从第一个氨基酸后都改变)
⑷①答案一:B 通过转基因技术,一是抑制正常植株A基因的表达,二是使A基因在矮生植株过量表达。C 测定两个实验组植株的赤霉素含量和株高。(答案二:B 通过转基因技术,使A基因在矮生植株过量表达,测定其赤霉素的含量和株高。C 通过转基因技术,抑制正常植株A基因的表达,测定其赤霉素的含量和株高。注:B和C次序不作要求)。②与对照比较,正常植株在A基因表达被抑制后,赤霉素的含量降低,株高降低;与对照比较,A基因在矮生植株过量表达后,该植株赤霉素的含量增加,株高增加。
利用生活中或实验中常见的物品,根据氧化还原反应知识和电化学知识,自己动手设计一个原电池。请填写下列空白:
(1)实验原理:Fe+2H+===Fe2++H2↑。
(2)实验原理:电极(______、______)、________、________、稀硫酸、耳机(或者电流计)。
(请在空格中填写所缺的实验用品)
(3)实验装置(如图)。
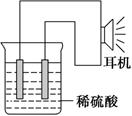
(4)原电池设计及注意的问题:
①按如图所示连接好实验仪器,注意观察(耳朵听)耳机是否有声音发出,如果没有,可将原电池的两个电极中的一极接触耳机插头上的一极(注意:接触的同时耳机的另一极是连接在原电池的另一个电极上的),这时可以听见耳机发出“嚓嚓嚓……”的声音。其原因是:在原电池中,由化学能转化为________,在耳机中又由________转化为声音这种能量。
②如果将装置中的耳机改为电流计,则铁钉应该接电流计的________极,电极反应是_____________________________,发生了________反应。
查看习题详情和答案>>
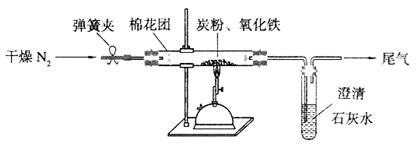
(15分)Ⅰ某研究性学习小组对过量炭粉与氧化铁反应的气体产物成分进行研究。
(1)提出假设:①该反应的气体产物是CO2。②该反应的气体产物是CO。③该反应的气体产物是 
(2)设计方案:如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比。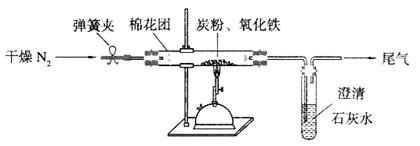
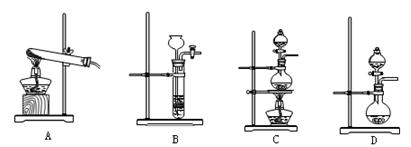
(3)查阅资料:氮气不与碳、氧化铁发生反应。实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应制得氮气。
①请写出该反应的离子方程式: 。
②下列装置可用于实验室制取氮气的是 。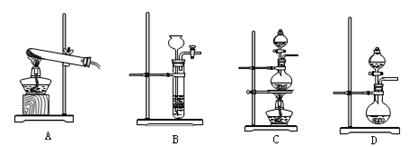
(4)实验操作及实验现象:
①按上图连接装置,并检查装置的气密性,称取3.20g氧化铁与2.00g炭粉混合均匀,放入48.48g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气;
③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水变浑浊;
④待反应结束,再通一段时间的氮气。冷却至室温,称得硬质玻璃管和固体总质量为52.24g。
(5)数据处理,经计算,参加反应的碳元素质量为0.48g,氧元素为0.96g。推断假设 成立。 该实验中发生的化学方程式为 。
该实验中发生的化学方程式为 。
(6)实验优化:根据实验得出的结论,应对该实验装置进一步完善,你认为应作如何改进? 。
Ⅱ由碳的氧化物直接合成甲醇、乙醇燃料已进入工业生产。如:
反应① CO(g)+2H2(g)  CH3OH(g)
CH3OH(g)
反应② 2CO(g)+4H2 (g) CH3CH2OH (g)+H2O (g)
CH3CH2OH (g)+H2O (g)
某同学为了寻找合成甲醇的适宜条件[温度、压强、碳氢比n(CO)/n(H2)、催化剂质量],设计了如下对比实验,部分实验条件已经填在下面实验设计表中(每次实验,反应时间相同)。
| 实验编号 | T(℃) | n (CO)/n(H2) | P(MPa) | CO转化率(%) |
| 1 | 150 | 1/3 | 0.1 | K^S*5U.C# |
| 2 | x | 1/3 | 5 | |
(2)若要探究温度、压强、碳氢比n(CO)/n(H2)、催化剂质量对合成甲醇的影响,除实验1、2外,至少还需进行 次对比实验。
(3)上述合成甲醇、乙醇的两个反应更符合绿色化学理念的是反应 (填编号),另一反应的平衡常数表达式为 。 K^S*5U.C# 查看习题详情和答案>>
请填写下列空白:
(1)实验原理:Fe+2H+=Fe2++H2↑。
(2)实验用品:电极(____、___)、稀硫酸、____、___(填写所缺的实验用品)、耳机(或者电流计) (3)实验装置:
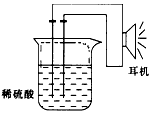
①按如图所示的装置连接好实验仪器,注意观察(耳朵听)耳机是否有声音发出,如果没有,可将原 电池的两个电极中的一极接触耳机插头上的一极(注意:接触的同时耳机的另一个电极是连接在原电池的另一个电极上的),这时可以听见耳机发出“嚓嚓嚓……”的声音。其原因是:在原电池中,由化学能转化为______,在耳机中又由______转化为声音这种能量。
②如果将装置中的耳机改为电流计,则铁钉应该接电流计的______极,电极反应是:______________,
发生了______反应;铜钉应该接电流计的______极,电极反应是:_________________, 发生了______反应。
利用生活中或实验室中常用的物品,根据氧化还原反应知识和电学知识,自己动手设计一个原电池。请填写下列空白:
(1)实验原理:Fe+2H+=Fe2++H2↑。
(2)实验用品:电极( 、 )、稀硫酸、 (填写所缺的实验用品)、耳机(或者电流计)
(3)实验装置 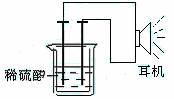
(4)原电池设计及注意的问题
①按如图所示连接好实验仪器,注意观察(耳朵听)耳机是否有声音发出,如果没有,可将原电池的两个电极中的一极接触耳机插头上的一极(注意:接触的同时耳机的另一个极是连接在原电池的另一个电极上的),这时可以听见耳机发出“嚓嚓嚓…………”声音。其原因是:在原电池中,由化学能转化为 ,在耳机中又由 转化为声音这种能量。
②如果将装置中的耳机改为电流计,则铁钉应该接电流计的 极,电极反应是: ,发生了 反应;铜钉应该接电流计的 极,电极反应是: ,发生了 反应。
查看习题详情和答案>>Ⅰ某研究性学习小组对过量炭粉与氧化铁反应的气体产物成分进行研究。
(1)提出假设:①该反应的气体产物是CO2。②该反应的气体产物是CO。③该反应的气体产物是 ![]()
(2)设计方案:如图所示,将一定量的氧化铁在隔绝空气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比。
(3)查阅资料:氮气不与碳、氧化铁发生反应。实验室可以用氯化铵饱和溶液和亚硝酸钠(NaNO2)饱和溶液混合加热反应制得氮气。
①请写出该反应的离子方程式: 。
②下列装置可用于实验室制取氮气的是 。
(4)实验操作及实验现象:
①按上图连接装置,并检查装置的气密性,称取3.20g氧化铁与2.00g炭粉混合均匀,放入48.48g的硬质玻璃管中;
②加热前,先通一段时间纯净干燥的氮气;
③停止通入N2后,夹紧弹簧夹,加热一段时间,澄清石灰水变浑浊;
④待反应结束,再通一段时间的氮气。冷却至室温,称得硬质玻璃管和固体总质量为52.24g。
(5)数据处理,经计算,参加反应的碳元素质量为0.48g ,氧元素为0.96g。推断假设 成立。 该实验中发生的化学方程式为 。
该实验中发生的化学方程式为 。
(6)实验优化:根据实验得出的结论,应对该实验装置进一步完善,你认为应作如何改进? 。
Ⅱ由碳的氧化物直接合成甲醇、乙醇燃料已进入工业生产。如:
反应① CO(g)+2H2(g) ![]() CH3OH(g)
CH3OH(g)
反应② 2CO(g)+4H2 (g)![]() CH3CH2OH (g)+H2O (g)
CH3CH2OH (g)+H2O (g)
某同学为了寻找合成甲醇的适宜条件[温度、压强、碳氢比n(CO)/n(H2)、催化剂质量],设计了如下对比实验,部分实验条件已经填在下面实验设计表中(每次实验,反应时间相同)。
| 实验编号 | T(℃) | n (CO)/n(H2) | P(MPa) | CO转化率(%) |
| 1 | 150 | 1/3 | 0.1 |
|
| 2 | x | 1/3 | 5 |