网址:http://m.1010jiajiao.com/timu_id_3208474[举报]
为测定碳酸钙纯度(设含杂质SiO2),学生设计了如下几个实验方案,请回答每个方案中的问题。
[方案I] (1)称取碳酸钙样品M g;
(2)加入过量盐酸;
(3)收集并测定生成的气体体积 V mL。
问题:如果称量样品时,砝码底部有一处未被实验者发现的残缺,那么测定的碳酸钙的纯度会 (偏高、偏低、无影响)
[方案II](1)称取碳酸钙样品 M g;
(2)用c mol/L 盐酸 V mL(过量)溶解样品;
(3)取溶解后的溶液![]() mL,用C′mol/L NaOH溶液滴定,恰好用去V′mL。
mL,用C′mol/L NaOH溶液滴定,恰好用去V′mL。
问题1:列出本实验中所用到的仪器名称(除铁架台及附件、烧杯之外)
。
问题2:加盐酸后是否需要滤出SiO2后再用NaOH滴定 (填选项编号)。
A.需要 B.不需要 C.均可
问题3:碳酸钙纯度计算公式 。
[方案III](1)称取碳酸钙样品 M g;
(2)高温(1000℃)煅烧直至质量不再发生变化,冷却后称量,质量为M′g。
问题1:为什么要煅烧至1000℃且“直至质量不再改变”? ;
问题2:本方案中的“冷却”应如何操作 。
[方案IV](1)称取碳酸钙样品 M g;
(2)加入足量Cmol/L盐酸V mL使之完全溶解;
(3)过滤并取滤液;
(4)在滤液中加入过量C′mol/L Na2CO3溶液V′mL;
(5)将步骤(4)中的沉淀滤出、洗涤、干燥、称重为M′g。
问题1:此方案中不需要的数据是 (填选项编号)。
A.C、V B.C′、 V′ C. M′ D. M
问题2:为减少实验误差,必要的操作是 (填选项编号)。
A.精确测定Na2CO3溶液体积V′ mL
B.精确配制浓度C′mol/LNa2CO3溶液
C.将步骤(3)所得沉淀洗涤,洗涤液也应并入(4)中
D.将步骤(3)所得沉淀洗涤、干燥、称量其质量M′g备用
问题3:步骤(5)中要将沉淀进行洗涤,如果未经洗涤,则测定的碳酸钙纯度将 (偏高、偏低、无影响)。
综上所述,你认为4个方案中,最好的方案是 ,其它方案的缺点分别是:
方案IV:沉淀的洗涤、干燥、称量操作过程复杂,容易造成较大误差;
方案 ; 。
方案 ; 。
查看习题详情和答案>>化合物X由元素A、B组成,可用于制造高性能的现代通讯材料-光导纤维;化合物Y由不同短周期元素C、D组成,是良好的耐热、耐冲击材料.
(1)已知A的一种单质是一种重要的半导体材料,则A在元素周期表中的位置是______.A可由X与焦炭在高温下反应制得,其反应的化学方程式为______.
(2)X与纯碱高温熔融时能生成Z,同时还生成一种气体M;将一定量气体M通入z的水溶液中生成白色沉淀和纯碱溶液.X与纯碱高温熔融能发生反应的原因是______;M与Z的水溶液能发生反应的原因是______.要将纯碱高温熔化,下列坩埚中不可选用的是______.
A.普通玻璃坩埚 B.石英玻璃坩埚
C.氧化铝坩埚 D.铁坩埚
(3)C的单质既可与盐酸、又可与NaOH溶液反应.一定条件下,Y和水作用生成含D的化合物W,W是一种含有10个电子的碱性气体.则Y的化学式是______.
(4)C的单质、石墨和二氧化钛(TiO2)按一定比例在高温下反应得到两种化合物,两种化合物均是由两种元素组成的新型陶瓷材料,则反应的化学方程式是(不必配平)______.
查看习题详情和答案>>
向一个体积可变的密闭容器中充入4 mol A、1 mol B,发生如下反应:4A(g)+B(s)![]() 3C(s)+4D(g).在高温下达到平衡,测得混合气体中D的浓度为0.3 mol·L-1.请填写下列空白:
3C(s)+4D(g).在高温下达到平衡,测得混合气体中D的浓度为0.3 mol·L-1.请填写下列空白:
(1)若容器体积为10 L,反应经2 min达平衡,则以A物质浓度变化表示的化学反应速率为________,达平衡时A物质的转化率为________.
(2)若压缩容器增大压强,则逆反应的速率________,容器中D的体积分数________(填“增大”“减小”或“不变”).
(3)若相对分子质量M(B)>3M(C),温度升高时混合气体的平均相对分子质量减小,则正反应________(填“吸热”或“放热”).
(4)在最初的容器中改充1.5 mol C、4.4 mol D,温度保持不变,要使反应达平衡时D的浓度为0.6 mol·L-1,则容器的体积是________L.

(1)用下图A所示实验装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”(石棉绒是耐高温材料,不与水反应).反应一段时间后,有肥皂泡吹起时,用点燃的火柴靠近肥皂泡,当
| ||
| ||
(2)为了研究一定时间内铁粉的转化率,他们设计了如下实验:准确称量一定质量的铁粉进行反应,收集并测量反应后生成的气体体积,计算出铁粉的转化率.
①收集并测量气体体积应选上图M,N中的
②称取0.24g铁粉与适量石棉绒混合,然后加热至无气体放出.若室温下氢气密度约为0.088g/L,最好选用
A.100ml B.200ml C.500ml D.1000ml
(3)为了证明反应后的固体混合物中含有+3价的Fe,他们计划取出少量混合物于试管中,加入足量的盐酸,溶解,过滤.向滤液中滴加KSCN溶液,观察溶液的颜色.在下表中填写滴加KSCN溶液后可能观察到的现象、结论与解释(可以不填满).
| 现象 | 结论与解释 | |
可能① |
||
可能② |
(1)工业上用黄铁矿(FeS2,其中S元素为-l价)在高温下和氧气反应制备SO2:4FeS2+11O2
| ||
(2)实验室中用如图1所示的装置测定SO2催化氧化为SO3,的转化率.(已知SO3熔点为16.8℃,假设气体进入装置时分别被完全吸收,且忽略空气中CO2的影响.)
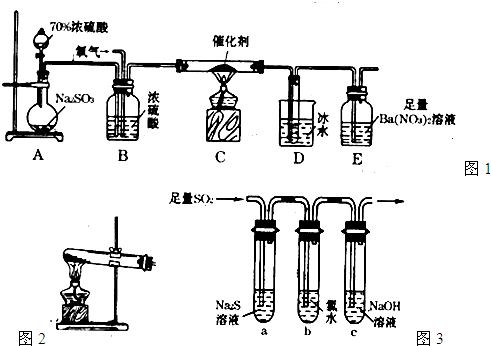
①简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作是
②实验过程中,需要通入氧气.试写出一个用图2所示装置制取氧气的化学方程式
| ||
| △ |
| ||
| △ |
③当停止通入SO2,熄灭酒精灯后,需要继续通一段时间的氧气,其目的是
④实验结束后,若装置D增加的质量为m g,装置E中产生白色沉淀的质量为n g,则此条件下二氧化硫的转化率是
| ||||
|
| ||||
|
(3)某学习小组设计用如图3装置验证二氧化硫的化学性质.
①能说明二氧化硫具有氧化性的实验现象为
②为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分成三份,分别进行如下实验:
方案I:向第一份溶液中加入AgNO3溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液加入品红溶液,红色褪去
方案Ⅲ:向第三份溶液加入BaCl2溶液,产生白色沉淀
上述方案中合理的是
③当通入二氧化硫至试管c中溶液显中性时,该溶液中c(Na+)=