题目内容
某研究小组为了探究“铁与水蒸气”能否发生反应及反应的产物,进行了系列实验.
(1)用下图A所示实验装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”(石棉绒是耐高温材料,不与水反应).反应一段时间后,有肥皂泡吹起时,用点燃的火柴靠近肥皂泡,当
(2)为了研究一定时间内铁粉的转化率,他们设计了如下实验:准确称量一定质量的铁粉进行反应,收集并测量反应后生成的气体体积,计算出铁粉的转化率.
①收集并测量气体体积应选上图M,N中的
②称取0.24g铁粉与适量石棉绒混合,然后加热至无气体放出.若室温下氢气密度约为0.088g/L,最好选用
A.100ml B.200ml C.500ml D.1000ml
(3)为了证明反应后的固体混合物中含有+3价的Fe,他们计划取出少量混合物于试管中,加入足量的盐酸,溶解,过滤.向滤液中滴加KSCN溶液,观察溶液的颜色.在下表中填写滴加KSCN溶液后可能观察到的现象、结论与解释(可以不填满).

(1)用下图A所示实验装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”(石棉绒是耐高温材料,不与水反应).反应一段时间后,有肥皂泡吹起时,用点燃的火柴靠近肥皂泡,当
肥皂泡破裂,有爆鸣声
肥皂泡破裂,有爆鸣声
时(填实验现象),说明“铁与水蒸气”能够进行反应.写出铁与水蒸气反应的化学方程式3Fe+4H2O
Fe3O4+4H2↑
| ||
3Fe+4H2O
Fe3O4+4H2↑
.
| ||
(2)为了研究一定时间内铁粉的转化率,他们设计了如下实验:准确称量一定质量的铁粉进行反应,收集并测量反应后生成的气体体积,计算出铁粉的转化率.
①收集并测量气体体积应选上图M,N中的
N
N
装置②称取0.24g铁粉与适量石棉绒混合,然后加热至无气体放出.若室温下氢气密度约为0.088g/L,最好选用
B
B
规格的量筒(选填字母序号)A.100ml B.200ml C.500ml D.1000ml
(3)为了证明反应后的固体混合物中含有+3价的Fe,他们计划取出少量混合物于试管中,加入足量的盐酸,溶解,过滤.向滤液中滴加KSCN溶液,观察溶液的颜色.在下表中填写滴加KSCN溶液后可能观察到的现象、结论与解释(可以不填满).
| 现象 | 结论与解释 | |
可能① |
||
可能② |
分析:(1)爆鸣声说明有氢气生成,即可说明“铁与水蒸气”能够进行反应;铁在高温下与水反应生成四氧化三铁和氢气,反应方程式为:3Fe+4H2O(g)
Fe3O4+4H2 ;
(2)①M收集装置错误,导气管位置错误,不可以测量生成氢气的体积;
②根据铁的质量求出生成氢气的质量,根据氢气的密度求出体积,以此选择量筒的规格.
| ||
(2)①M收集装置错误,导气管位置错误,不可以测量生成氢气的体积;
②根据铁的质量求出生成氢气的质量,根据氢气的密度求出体积,以此选择量筒的规格.
解答:解:(1)铁与水蒸气生成氢气,反应一段时间后,有肥皂泡吹起时,用点燃的火柴靠近肥皂泡,不纯的氢气在点燃时会有爆鸣声;铁在高温下与水反应生成四氧化三铁和氢气,反应方程式为:3Fe+4H2O(g)
Fe3O4+4H2 ;故答案为:肥皂泡破裂,爆鸣声; 3Fe+4H2O(g)
Fe3O4+4H2 ;
(2)①排水法收集气体,量气装置的导气管应短进长出,否则不能将水排到量筒中,无法测量气体的体积,故答案为:N;
②根据反应计算:
3Fe+4H2O(g)
Fe3O4+4H2
3×56g 8g
0.24g m(H2)
m(H2)=
=0.0114g
V(H2)=
=0.13L
选择量筒时,应尽量减少误差,所取量筒规格与量取体积接近,故应选择规格为200ml的量筒,故答案为:B;
(3)为了证明反应后的固体混合物中含有+3价的Fe,取出少量混合物于试管中,加入足量的盐酸,溶解,过滤.向滤液中滴加KSCN溶液,观察溶液的颜色变化分析铁离子的存在,铁离子遇硫氰酸钾溶液会变血红色;铁剩余会在溶液中和铁离子反应生成亚铁离子,依据溶液颜色分析离子存在,血红色说明一定含三价铁离子;浅绿色溶液可能是铁和铁离子反应生成亚铁离子;
故答案为:
| ||
| ||
(2)①排水法收集气体,量气装置的导气管应短进长出,否则不能将水排到量筒中,无法测量气体的体积,故答案为:N;
②根据反应计算:
3Fe+4H2O(g)
| ||
3×56g 8g
0.24g m(H2)
m(H2)=
| 024g×8g |
| 3×56g |
V(H2)=
| 0.0114g |
| 0.088g/L |
选择量筒时,应尽量减少误差,所取量筒规格与量取体积接近,故应选择规格为200ml的量筒,故答案为:B;
(3)为了证明反应后的固体混合物中含有+3价的Fe,取出少量混合物于试管中,加入足量的盐酸,溶解,过滤.向滤液中滴加KSCN溶液,观察溶液的颜色变化分析铁离子的存在,铁离子遇硫氰酸钾溶液会变血红色;铁剩余会在溶液中和铁离子反应生成亚铁离子,依据溶液颜色分析离子存在,血红色说明一定含三价铁离子;浅绿色溶液可能是铁和铁离子反应生成亚铁离子;
| 现象 | 结论与解释 | |
| 可能① | 溶液变为红色 | 反应后的固体混合物中含有+3价的Fe. 因为Fe3+遇到KSCN溶液时变成血红色. |
可能② |
溶液仍然为浅绿色 |
反应后的固体混合物中可能含有+3价的Fe,也可能不含+3价的Fe;因为如果铁粉有剩余,剩余铁粉会与Fe3+反应,将溶液中Fe3+完全还原为Fe2+. |
| 现象 | 结论与解释 | |
| 可能① | 溶液变为红色 | 反应后的固体混合物中含有+3价的Fe. 因为Fe3+遇到KSCN溶液时变成血红色. |
可能② |
溶液仍然为浅绿色 |
反应后的固体混合物中可能含有+3价的Fe,也可能不含+3价的Fe;因为如果铁粉有剩余,剩余铁粉会与Fe3+反应,将溶液中Fe3+完全还原为Fe2+. |
点评:本题考查铁及其化合物的性质实验,离子检验方法的应用,现象的分析判断,本题难度不大,易错点为量筒规格的选择.

练习册系列答案
相关题目
 某研究小组为了探究“铁与水蒸气”能否发生反应及反应的产物,进行了下列实验:(1)用如图所示实验装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”(石棉绒是耐高温材料,不与水和铁反应).
某研究小组为了探究“铁与水蒸气”能否发生反应及反应的产物,进行了下列实验:(1)用如图所示实验装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”(石棉绒是耐高温材料,不与水和铁反应).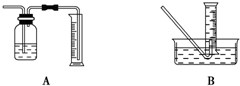
 (2010?厦门二模)某研究小组为了探究甲烷和氯气反应的情况,设计了几个实验,请填空:
(2010?厦门二模)某研究小组为了探究甲烷和氯气反应的情况,设计了几个实验,请填空: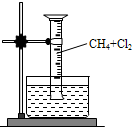 某研究小组为了探究甲烷和氯气反应的情况,设计了几个实验.
某研究小组为了探究甲烷和氯气反应的情况,设计了几个实验.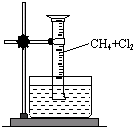 某研究小组为了探究甲烷和氯气反应的情况,设计了几个实验.
某研究小组为了探究甲烷和氯气反应的情况,设计了几个实验.