摘要:A.NH3 B.HCN C.CO(NH2)2 D.BF3
网址:http://m.1010jiajiao.com/timu_id_3208304[举报]
现有A、B、D、E、G原子序数依次增大的五种短周期元素,其中A的原子半径与G的原子半径之比最小,B、D、E三种元素原子的电子层数相同,同一周期中B的一种单质的熔点最高,E与A、B、D、G均能形成多种常见化合物.
(1)BE2的电子式是
 .
.
(2)实验室制取B2A2的化学方程式是:
(3)常温下液态化合物甲只含上述元素中的两种,分子中原予个数比为1:1,仅用一个化学方程式表示甲既有氧化性又有还原性:
(4)电解质乙和丙由上述元素中的几种组成,l mol乙或丙中均含有20mol电子,丙可以抑制乙在水溶液中的电离,则丙中的化学键类型有
(5)由A、B两元素形成的含18个电子的气态化合物,该化合物与氧气和KOH溶液可构成燃料电池,写出该燃料电池负极电极反应式:
查看习题详情和答案>>
(1)BE2的电子式是


(2)实验室制取B2A2的化学方程式是:
CaC2+2H2O→Ca(OH)2+HC≡CH↑
CaC2+2H2O→Ca(OH)2+HC≡CH↑
(3)常温下液态化合物甲只含上述元素中的两种,分子中原予个数比为1:1,仅用一个化学方程式表示甲既有氧化性又有还原性:
2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
.
| ||
(4)电解质乙和丙由上述元素中的几种组成,l mol乙或丙中均含有20mol电子,丙可以抑制乙在水溶液中的电离,则丙中的化学键类型有
离子键,极性共价健
离子键,极性共价健
,乙的电离方程式是NH3?H2O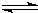 NH4++OH-
NH4++OH-
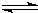 NH4++OH-
NH4++OH-NH3?H2O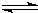 NH4++OH-
NH4++OH-
.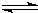 NH4++OH-
NH4++OH-(5)由A、B两元素形成的含18个电子的气态化合物,该化合物与氧气和KOH溶液可构成燃料电池,写出该燃料电池负极电极反应式:
C2H6-14e-+180H-=2CO32-+12H2O
C2H6-14e-+180H-=2CO32-+12H2O
.
下列离子方程式书写正确的是 ( )。
A.Fe与盐酸反应:Fe+2H+=Fe2++H2↑
B.次氯酸钙溶液中通入过量CO2:Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO
C.用氨水吸收少量的SO2:NH3?H2O+SO2=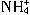 +HS
+HS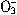
D.碳酸氢钙溶液中加入过量的NaOH溶液:HC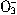 +OH-=C
+OH-=C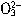 +H2O
查看习题详情和答案>>
+H2O
查看习题详情和答案>>
A.Fe与盐酸反应:Fe+2H+=Fe2++H2↑
B.次氯酸钙溶液中通入过量CO2:Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO
C.用氨水吸收少量的SO2:NH3?H2O+SO2=
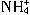 +HS
+HS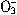
D.碳酸氢钙溶液中加入过量的NaOH溶液:HC
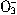 +OH-=C
+OH-=C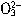 +H2O
查看习题详情和答案>>
+H2O
查看习题详情和答案>>
固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体原子的最外电子层结构,则下列是有说法中,不正确的是( )
A.1molNH5中含有5NA个N—H键(NA表示阿伏加德罗常数)
B.NH5中既有共价键又有离子键
 H
H
C.NH5的电子式为:[H:N:H]+[:H]-
H
D.它与水的反应的离子方程式为:NH4++H-+H2O=NH3·H2O+H2↑
查看习题详情和答案>>
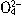 =BaSO4↓
=BaSO4↓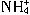 + OH-= NH3?H2O
+ OH-= NH3?H2O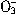 = H2O+CaCO3↓
= H2O+CaCO3↓ H
H