网址:http://m.1010jiajiao.com/timu_id_3207923[举报]
(1)工业生产可以用NH3(g)与CO2(g)经过两步反应生成尿素,两步反应的能量变化示意图如图:
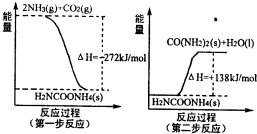
则NH3(g)与CO2(g)反应生成尿素的热化学方程式为
(2)已知反应Fe(s)+CO2(g)?FeO(s)+CO(g)△H=akJ.mol-1.测得在不同温度下,该反应的平衡常数K随温度的变化如下:
| 温度/ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
②700℃反应达到平衡后,要使该平衡向右移动,其他条件不变时,可以采取的措施有
A.缩小反应器容积 B.增加Fe的物质的量
C.升高温度到900℃D.使用合适的催化剂
(3)硫酸厂常用NaOH溶液吸收SO2废气.当吸收液呈中性时,溶液中离子浓度关系正确的是[已知n(SO
2- 3 |
- 3 |
A、c(Na+)=2c(SO
2- 3 |
- 3 |
B、c(Na+)>c(HSO
- 3 |
2- 3 |
C、c(Na+)+c(H+)=c(SO
2- 3 |
- 3 |
化学反应原理在工业生产中具有十分重要的意义。
(1)工业生产可以用NH3(g)与CO2(g)经过两步反应生成尿素,两步反应的能量变化示意图如下:
则NH3(g)与CO2(g)反应生成尿素的热化学方程式为 。
(2)已知反应Fe(s) +CO2(g)  FeO(s) +CO(g) ΔH ="a" kJ/mol
FeO(s) +CO(g) ΔH ="a" kJ/mol
测得在不同温度下,该反应的平衡常数K随温度的变化如下:
①该反应的化学平衡常数表达式K= ,a 0(填“>”、“<”或“=”)。在500℃ 2L密闭容器中进行反应,Fe和CO2的起始量均为4 mol,则5 min后达到平衡时CO2的转化率为 ,生成CO的平均速率v(CO)为 。
②700℃反应达到平衡后,要使该平衡向右移动,其他条件不变时,可以采取的措施有
(填字母)。
| A.缩小反应器容积 | B.增加Fe的物质的量 |
| C.升高温度到900℃ | D.使用合适的催化剂 |
(10分) 化学平衡移动原理同样也适用于其它平衡, 已知在氨水中存在下列平衡:NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4+ +OH-。
NH4+ +OH-。
(1)向氨水中加入 MgCl2固体时,平衡向 (填“正反应或逆反应”下同)方向移动,OH- 离子浓度 ,NH4+的浓度 。
(2)向氨水中加入浓盐酸,平衡向 方向移动,此时溶液中浓度减小的微粒有 、 、 。
(3)向浓氨水中加入少量NaOH固体,平衡向 方向移动,此时观察到的现象是 ,原因是 。
查看习题详情和答案>>(1)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)?2SO3(g),混合体系中SO3的质量分数和温度的关系如图1所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题:

①2SO2(g)+O2(g)?2SO3(g)的△H
②若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1
(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.
①图2是一定的温度和压强下N2和H2反应生成1mol NH3过程中能量变化示意图,请写出合成氨的热化学反应方程式:
②氨气溶于水得到氨水.在25℃下,将xmol?L-1的氨水与ymol?L-1的盐酸等体积混合,所得溶液呈中性.则x
| 10-7y |
| x-y |
| 10-7y |
| x-y |
(3)海水中含有大量的元素,常量元素如氯、微量元素如碘在海水中均以化合态存在.在25℃下,向0.1mol?L-1的NaCl溶液中逐滴加入适量的0.1mol?L-1硝酸银溶液,有白色沉淀生成,向反应后的浊液中,继续加入0.1mol?L-1的NaI溶液,看到的现象是
(1)合成氨反应N2(g)+3H2(g)
 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡__________移动(填“向左”“向右”或“不”);使用催化剂,上述反应的△H________(填“增大” “减小” 或“不改变”)。
(2)一氧化碳在高温下与水蒸气反应的方程式为:CO+H2O
 CO2+H2。已知部分物质燃烧的热化学方程式如下:
CO2+H2。已知部分物质燃烧的热化学方程式如下:2H2(g) + O2(g) =2H2O(l);△H=-571.6kJ·mol-1
2CO(g) + O2(g) =2CO2(g) ;△H=-566kJ·mol-1
又知1molH2O(g)转变为1mol H2O(l)时放出44.0kJ热量。写出CO和水蒸气在高温催化剂下反应的热化学方程式______________________。
(3)在25℃下,向浓度为0.1 mol·L-1的AlCl3溶液中逐滴加入氨水,生成该沉淀的离子方程式为
______________________________。
(4)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制造新型燃烧电池,放电过程中,溶液中铵根离子浓度逐渐增大。请写出该电池的正极反应式
_____________。
(5)某温度(t℃)时,测得0.01mol·L-1的NaOH溶液的pH=11。在此温度下,将pH=1的H2SO4溶液
VaL与pH=11的NaOH溶液VbL混合,若所得混合液为中性,则 Va︰Vb=___________。
(6)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)=
c(Cl-)。则溶液显_____________性(填“酸”“碱”或“中”)